فهرست عناوین
- تعریف علمی اسید استیک : یک ترکیب آلی مهم
- فرمول مولکولی اسید استیک و ویژگی های ساختاری آن
- پیوندهای شیمیایی در ساختار اسید استیک
- ویژگی های فیزیکی و شیمیایی اسید استیک
- حالت های فیزیکی اسید استیک و پدیده اسید استیک یخی
- چگونگی حل شدن اسید استیک در آب و سایر حلال ها
- اثر پیوندهای هیدروژنی در ساختار اسید استیک
- روش های طیف سنجی برای بررسی ساختار مولکولی اسید استیک
- مقایسه اسید استیک با سایر اسیدهای کربوکسیلیک
- نقش گروه کربوکسیل در واکنش های شیمیایی اسید استیک
- ساختار رزونانسی اسید استیک و تأثیر آن بر پایداری مولکول
- نحوه تشکیل و تجزیه اسید استیک در طبیعت و صنعت
نوشته شده توسط شرکت صنایع استیک ایران
منتشر شده توسط شرکت صنایع استیک ایران
تاریخ انتشار مقاله : 18-11-1403
تاریخ بروزرسانی مقاله : 18-11-1403
تعداد کلمات : 1700
آدرس مقاله : لینک مقاله
تعریف علمی و ساختار مولکولی اسید استیک

تعریف علمی اسید استیک : یک ترکیب آلی مهم
اسید استیک (با نام سیستماتیک اتانوئیک اسید) یک ترکیب آلی مونوکربوکسیلیک با فرمول شیمیایی CH₃COOH است. این اسید کربوکسیلیک ساده مایعی بی رنگ و خورنده با بوی تند و مشخص است که به طور طبیعی در سرکه (با غلظت 4 تا 8 درصد) یافت می شود. اسید استیک خالص در دمای کمتر از 16.6 درجه سانتیگراد به صورت جامد کریستالی بی رنگ (اسید استیک یخی) تبلور می یابد. این ترکیب به عنوان یک اسید ضعیف طبقه بندی می شود به این معنی که در آب به طور کامل یونیزه نمی شود. ویژگی اسیدی اسید استیک ناشی از گروه کربوکسیل (-COOH) است که یک پروتون (H⁺) را در محلول آبی آزاد می کند. کاربردهای اسید استیک بسیار گسترده است از تولید سرکه و چاشنی ها تا تولید پلیمرها و حلال ها در صنایع شیمیایی. اهمیت اسید استیک در صنایع مختلف به دلیل خواص شیمیایی منحصر به فرد آن از جمله قدرت اسیدی متوسط ، قابلیت انحلال بالا و واکنش پذیری مناسب است.
فرمول مولکولی اسید استیک و ویژگی های ساختاری آن
فرمول مولکولی اسید استیک CH₃COOH است که نشان دهنده وجود یک گروه متیل (CH₃) متصل به یک گروه کربوکسیل (-COOH) است. اتم کربن گروه متیل با پیوندهای کووالانسی ساده به سه اتم هیدروژن و یک اتم کربن دیگر متصل است. اتم کربن گروه کربوکسیل با پیوند دوگانه به یک اتم اکسیژن و پیوند ساده به یک گروه هیدروکسیل (-OH) متصل شده است. ساختار مولکولی اسید استیک شامل یک گروه کربوکسیل نسبتا قطبی و یک گروه متیل نسبتا ناقطبی است. قطبیت گروه کربوکسیل منجر به ایجاد پیوندهای هیدروژنی قوی بین مولکول های اسید استیک و همچنین افزایش حلالیت آن در آب می شود. در ادامه بررسی ویژگی های فیزیکی و شیمیایی اسید استیک باید دقت نمود که این ساختار مسطح نیست اما گروه کربوکسیل تقریباً در یک صفحه قرار می گیرد و باعث ایجاد گشتاور دو قطبی در مولکول می شود.
پیوندهای شیمیایی در ساختار اسید استیک
ساختار اسید استیک عمدتاً از پیوندهای کووالانسی تشکیل شده است. پیوندهای قوی کووالانسی بین اتم های کربن ، اکسیژن و هیدروژن اسکلت مولکول را تشکیل می دهند. پیوند C-H در گروه متیل پیوندهای کووالانسی نسبتا غیر قطبی هستند در حالی که پیوندهای C=O و C-O در گروه کربوکسیل پیوندهای کووالانسی قطبی هستند به دلیل اختلاف الکترونگاتیوی قابل توجه بین کربن و اکسیژن. وجود پیوند قطبی C=O باعث ایجاد یک گشتاور دو قطبی در مولکول می شود. پیوند هیدروژنی بین اتم هیدروژن گروه هیدروکسیل (-OH) یک مولکول اسید استیک و اتم اکسیژن گروه کربونیل (C=O) مولکول مجاور نقش مهمی در خواص فیزیکی اسید استیک مانند نقطه جوش بالا و حلالیت قابل توجه در آب دارد. پیوندهای هیدروژنی نیروهای بین مولکولی نسبتا قوی هستند که بر خواص فیزیکی اسید استیک تأثیر می گذارند.
| نوع پیوند | اتمهای درگیر | طول پیوند (آنگستروم) | زاویه پیوند (درجه) | انرژی پیوند (کیلوژول/مول) | نوع اوربیتال | قطبیت پیوند | مثال در ساختار |
|---|---|---|---|---|---|---|---|
| کوالانسی | C-H | 1.09 | 109.5 | 412 | sp3 | کم | اتان |
| کوالانسی | C-H | 1.09 | 109.5 | 412 | sp3 | کم | اتان |
| کوالانسی | C-H | 1.09 | 109.5 | 412 | sp3 | کم | اتان |
| کوالانسی | C-C | 1.54 | 109.5 | 348 | sp3 | کم | اتان |
| کوالانسی | C-O | 1.43 | 120 | 360 | sp2 | متوسط | الکلها |
| کوالانسی | C=O | 1.20 | 120 | 799 | sp2 | زیاد | کربونیلها |
| کوالانسی | O-H | 0.96 | 104.5 | 463 | sp3 | زیاد | آب |
ویژگی های فیزیکی و شیمیایی اسید استیک
اسید استیک (CH₃COOH) مایعی بی رنگ ، فرار و با بوی تند و مشخص است. نقطه جوش آن 118 درجه سانتی گراد و نقطه انجماد آن 16.6 درجه سانتی گراد است. این تفاوت در نقاط جوش و ذوب نسبت به سایر ترکیبات با جرم مولکولی مشابه به دلیل وجود پیوندهای هیدروژنی قوی بین مولکول های اسید استیک است. اسید استیک به راحتی در آب و بسیاری از حلال های آلی قطبی مانند اتانول و استون حل می شود اما در حلال های غیر قطبی مانند هگزان حلالیت کمتری دارد. این حلالیت بالا در آب به دلیل قطبیت گروه کربوکسیل (-COOH) و توانایی تشکیل پیوندهای هیدروژنی با مولکول های آب است. اسید استیک یک اسید ضعیف است به این معنی که در آب به طور کامل یونیزه نمی شود و تعادل بین فرم مولکولی و یونی آن برقرار است. این ویژگی اسید استیک را برای کاربرد در بسیاری از فرآیندهای شیمیایی و صنایع غذایی مناسب می کند.
حالت های فیزیکی اسید استیک و پدیده اسید استیک یخی
اسید استیک در دمای اتاق مایعی بی رنگ است. با کاهش دما زیر دمای 16.6 درجه سانتی گراد به حالت جامد کریستالی در می آید که به آن اسید استیک یخی گفته می شود. این نامگذاری به دلیل شباهت ظاهری بلورهای اسید استیک یخ زده به یخ است. این تغییر حالت فیزیکی به دلیل وجود پیوندهای هیدروژنی قوی بین مولکول های اسید استیک است. پیوندهای هیدروژنی نیروهای بین مولکولی نسبتا قوی هستند که باعث می شوند مولکول های اسید استیک به صورت منظم در ساختار بلوری مرتب شوند. این ساختار بلوری مرتب باعث افزایش نقطه ذوب و سختی اسید استیک می شود. اسید استیک یخی در بسیاری از کاربردهای صنعتی و آزمایشگاهی استفاده می شود.
چگونگی حل شدن اسید استیک در آب و سایر حلال ها
اسید استیک به دلیل ماهیت قطبی گروه کربوکسیل (-COOH) خود ، به خوبی در آب حل می شود. این گروه پیوندهای هیدروژنی قوی با مولکول های آب تشکیل می دهد. مولکول های آب با پیوند هیدروژنی به اتم های اکسیژن و هیدروژن گروه کربوکسیل متصل می شوند و اسید استیک را در آب محلول می کنند. در حلال های آلی قطبی مانند اتانول و استون نیز به دلیل برقراری پیوند هیدروژنی و نیروهای بین مولکولی دیگر اسید استیک به خوبی حل می شود. در مقابل در حلال های غیر قطبی مانند هگزان به دلیل عدم برقراری پیوند هیدروژنی مؤثر اسید استیک به خوبی حل نمی شود. این خاصیت حلالیت اسید استیک در آب و برخی حلال های آلی در بسیاری از کاربردهای صنعتی و آزمایشگاهی مهم است.
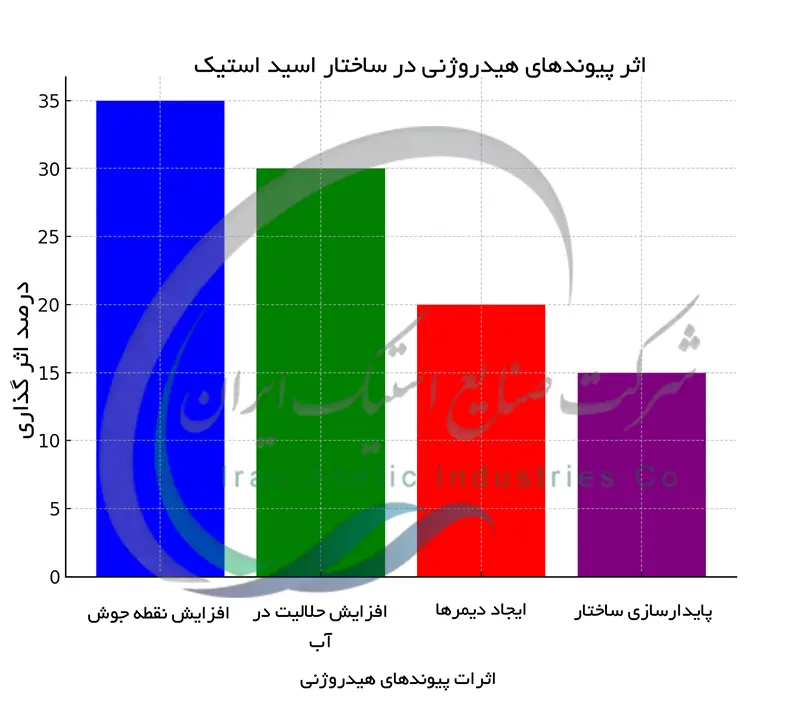
اثر پیوندهای هیدروژنی در ساختار اسید استیک
وجود گروه هیدروکسیل (-OH) در گروه کربوکسیل اسید استیک باعث ایجاد پیوندهای هیدروژنی بین مولکولی می شود. اتم هیدروژن گروه هیدروکسیل یک مولکول اسید استیک با اتم اکسیژن گروه کربونیل(C=O) مولکول مجاور پیوند هیدروژنی برقرار می کند. این پیوندهای هیدروژنی نیروهای بین مولکولی نسبتا قوی هستند که باعث افزایش نقطه جوش اسید استیک می شود. بدون این پیوندها نقطه جوش اسید استیک بسیار پایین تر بود. پیوندهای هیدروژنی تأثیر قابل توجهی بر حلالیت اسید استیک در آب دارند. قطبیت گروه کربوکسیل و توانایی تشکیل پیوندهای هیدروژنی با مولکول های آب باعث می شود اسید استیک به خوبی در آب حل شود. این ویژگی ها نقش کلیدی در خواص فیزیکی و شیمیایی اسید استیک دارند.
روش های طیف سنجی برای بررسی ساختار مولکولی اسید استیک
طیف سنجی مادون قرمز (IR) با شناسایی ارتعاشات پیوندهای شیمیایی در مولکول اسید استیک اطلاعات ارزشمندی درباره ساختار آن ارائه می دهد. نوارهای جذبی مشخص در ناحیه های مختلف طیف IR مربوط به گروه های عاملی مختلف مانند پیوند O-H هیدروکسیل C=O ، (کربونیل) و C-H می باشد. موقعیت و شدت این نوارها اطلاعاتی درباره نوع پیوندها ، طول پیوندها و قدرت پیوندهای هیدروژنی می دهد. طیف سنجی رزونانس مغناطیسی هسته ای (NMR) با استفاده از هسته های هیدروژن (¹H NMR) و کربن (¹³C NMR) ساختار مولکولی اسید استیک را با جزئیات بیشتری آشکار می کند. در طیف ¹H NMR سیگنال های مختلف مربوط به هیدروژن های گروه متیل (CH₃) و هیدروژن گروه کربوکسیل (-COOH) مشاهده می شود که اطلاعاتی درباره محیط شیمیایی هسته های هیدروژن می دهد. طیف ¹³C NMR نیز موقعیت اتم های کربن و نوع پیوند آنها را نشان می دهد. ترکیب اطلاعات بدست آمده از IR و NMR تصویر کاملی از ساختار مولکولی اسید استیک ارائه می دهد.
مقایسه اسید استیک با سایر اسیدهای کربوکسیلیک
اسید استیک ، اسید فرمیک و اسید پروپیونیک سه اسید کربوکسیلیک ساده هستند که تفاوت های جزئی در ساختار و خواص دارند. اسید استیک دارای یک گروه متیل (CH₃) متصل به گروه کربوکسیل است در حالی که اسید فرمیک فاقد گروه آلکیل و اسید پروپیونیک دارای یک گروه اتیل (CH₂CH₃) است. این تفاوت در ساختار بر قدرت اسیدی آنها اثر می گذارد. اسید فرمیک قوی ترین اسید این سه است زیرا گروه آلکیل فاقد اثر القایی به دلیل نداشتن گروه آلکیل است. اسید استیک قدرت اسیدی متوسطی دارد و اسید پروپیونیک ضعیف ترین اسید است زیرا گروه اتیل اثر القایی مثبت کمی دارد و کمی قدرت اسیدی را کاهش می دهد. تفاوت های دیگر در نقطه جوش ، حلالیت و دیگر خواص فیزیکی نیز مشاهده می شود.
نقش گروه کربوکسیل در واکنش های شیمیایی اسید استیک
گروه کربوکسیل (-COOH) عامل اصلی واکنش پذیری اسید استیک است. اتم هیدروژن گروه هیدروکسیل (OH) به راحتی می تواند به عنوان پروتون (H⁺) یونیزه شود و اسید استیک را به عنوان یک اسید ضعیف عمل کند. این خاصیت اسیدی باعث واکنش اسید استیک با بازها می شود. واکنش اسید استیک با بازها منجر به تشکیل نمک های استات می شود. گروه کربوکسیل همچنین در واکنش های استری شدن شرکت می کند که در آن اسید استیک با الکل ها واکنش داده و استر تولید می کند. در این واکنش اتم هیدروژن گروه هیدروکسیل اسید استیک با گروه آلکیل الکل جایگزین می شود و پیوند استری تشکیل می شود. گروه کربوکسیل در واکنش های اکسیداسیون نیز شرکت می کند که در آن اسید استیک به دی اکسید کربن و آب اکسید می شود. گروه کربوکسیل نقش محوری در کاربردهای گسترده اسید استیک دارد.
ساختار رزونانسی اسید استیک و تأثیر آن بر پایداری مولکول
در مولکول اسید استیک گروه کربوکسیل (-COOH) ساختار رزونانسی از خود نشان می دهد. جفت الکترون غیرپیوندی روی اتم اکسیژن گروه هیدروکسیل با پیوند دوگانه کربن-اکسیژن گروه کربونیل (C=O) هم پوشانی دارند. این امر منجر به تشکیل دو ساختار رزونانسی می شود که در آن ها پیوند دوگانه کربن-اکسیژن در بین دو اتم اکسیژن گروه کربوکسیل به طور مساوی پخش می شود. در نتیجه پیوند کربن-اکسیژن در گروه کربوکسیل به صورت پیوند 1.5 (بین پیوند ساده و دوگانه) در می آید. این پخش بار باعث افزایش پایداری مولکول اسید استیک می شود. طول پیوند C-O در هر دو اکسیژن برابر و کوتاه تر از پیوند ساده C-O اما بلندتر از پیوند دوگانه C=O است. این پایداری نسبی با کاهش واکنش پذیری اسید استیک در برخی واکنش ها مانند واکنش های اکسیداسیون قابل مشاهده است. ساختار رزونانسی نقش مهمی در خواص شیمیایی اسید استیک دارد.
نحوه تشکیل و تجزیه اسید استیک در طبیعت و صنعت
اسید استیک در طبیعت عمدتاً از طریق فرآیندهای تخمیر بیولوژیکی تولید می شود. باکتری های استوباکتری در حضور اکسیژن ، اتانول را به اسید استیک اکسید می کنند. این فرایند در تولید سرکه استفاده می شود که موجب افزایش جزئی برخی هزینه ها در خرید حواله اسید استیک می گردد. برخی از میوه ها و سبزیجات به طور طبیعی مقداری اسید استیک دارند. تجزیه اسید استیک در طبیعت طی فرآیندهای متابولیکی میکروارگانیسم ها انجام می شود. در صنعت اسید استیک عمدتاً با کربونیلاسیون متانول در حضور کاتالیزور رودیوم تولید می شود. این فرآیند منجر به تولید اسید استیک با خلوص بالا می شود. روش های دیگر صنعتی تولید اسید استیک شامل تخمیر بیولوژیکی و اکسیداسیون آلدئیدها است. تجزیه اسید استیک در صنعت معمولاً به صورت واکنش های شیمیایی با مواد دیگر انجام می شود مانند واکنش با بازها که منجر به تولید نمک های استات می شود.





فرمول مولکولی اسید استیک (CH3COOH) و خواص آن
تفاوت ساختار اسید استیک با سایر اسیدهای آلی