فهرست عناوین
- ساختار شیمیایی اسید استیک
- ویژگی های فیزیکی اسید استیک
- حل شدگی و انحلال پذیری اسید استیک
- طعم و بوی اسید استیک
- کشش سطحی و گرانروی اسید استیک
- واکنش های شیمیایی اسید استیک
- نقش اسید استیک در صنعت شیمیایی
- پایداری و فساد اسید استیک
- اسید استیک در صنایع غذایی : کاربردها و مزایا
- مقایسه اسید استیک با سایر اسیدهای آلی
- استفاده از اسید استیک در پزشکی و داروسازی
نوشته شده توسط شرکت صنایع استیک ایران
منتشر شده توسط شرکت صنایع استیک ایران
تاریخ انتشار مقاله : 23-11-1403
تاریخ بروزرسانی مقاله : 23-11-1403
تعداد کلمات : 1470
آدرس مقاله : لینک مقاله
ویژگی های فیزیکی و شیمیایی اسید استیک

ساختار شیمیایی اسید استیک
اسید استیک با فرمول شیمیایی CH₃COOH ساده ترین اسید کربوکسیلیک است. حال می خواهیم به تعریف علمی و ساختار مولکولی اسید استیک بپردازیم. مولکول آن از یک گروه متیل (CH₃) متصل به یک گروه کربوکسیل (-COOH) تشکیل شده است. گروه کربوکسیل شامل یک اتم کربن به پیوند دوگانه با یک اتم اکسیژن و پیوند تک با یک گروه هیدروکسیل (-OH) است. این گروه عاملی مسئول بسیاری از ویژگی های شیمیایی اسید استیک از جمله خاصیت اسیدی آن است. پیوند هیدروژنی بین مولکول های اسید استیک به دلیل وجود گروه کربوکسیل بر خواص فیزیکی آن تاثیر می گذارد. ساختار مسطح گروه کربوکسیل امکان رزونانس را فراهم می کند که بر پایداری مولکول می افزاید.
ویژگی های فیزیکی اسید استیک
اسید استیک خالص مایعی بی رنگ با بوی تند و مشخص است. دمای ذوب آن 16.6 درجه سانتیگراد و نقطه جوش آن 118.1 درجه سانتیگراد است. چگالی اسید استیک در دمای اتاق حدود 1.05 گرم بر سانتی متر مکعب است. ویسکوزیته نسبتاً بالایی دارد که ناشی از پیوند هیدروژنی بین مولکول هاست. در دمای پایین تر از دمای ذوب اسید استیک به صورت بلوری جامد درمی آید. قابلیت انحلال پذیری آن در آب بسیار بالا است و به هر نسبت با آب مخلوط می شود. این ویژگی به دلیل قطبیت بالای مولکول اسید استیک است. علاوه بر آب در حلال های آلی قطبی نیز به خوبی حل می شود.
حل شدگی و انحلال پذیری اسید استیک
اسید استیک به خوبی در آب حل می شود و محلول های آبی آن را تشکیل می دهد. این انحلال پذیری بالا به دلیل قطبیت بالای مولکول اسید استیک و توانایی آن در ایجاد پیوند هیدروژنی با مولکول های آب است. پیوند هیدروژنی بین گروه کربوکسیل (-COOH) اسید استیک و مولکول های آب انرژی آزاد گیبس انحلال را کاهش می دهد و فرایند انحلال را آسان تر میکند. اسید استیک همچنین در بسیاری از حلال های آلی قطبی مانند الکل ها (مانند متانول و اتانول) و کتون ها قابلیت انحلال بالایی دارد. در حلال های غیرقطبی انحلال پذیری اسید استیک به طور قابل توجهی کمتر است. این رفتار نشان دهنده ماهیت قطبی مولکول اسید استیک است. غلظت اسید استیک در محلول بر خواص فیزیکی و شیمیایی آن تأثیر می گذارد.
| حلال | انحلالپذیری در دمای ۲۵°C (گرم در ۱۰۰ میلیلیتر) | اثر دما بر انحلالپذیری | حالت فیزیکی در حلال | اثر pH بر انحلالپذیری | نوع پیوند بین مولکولی |
|---|---|---|---|---|---|
| آب | کاملاً محلول | افزایش | مایع شفاف | کاهش با افزایش pH | هیدروژنی |
| اتانول | کاملاً محلول | افزایش | مایع شفاف | کاهش با افزایش pH | هیدروژنی |
| متانول | کاملاً محلول | افزایش | مایع شفاف | کاهش با افزایش pH | هیدروژنی |
| اتر | متوسط | کاهش | مایع شفاف | تغییر کم | واندروالس |
| کلروفرم | متوسط | کاهش | مایع شفاف | تغییر کم | واندروالس |
| بنزن | کم | کم تغییر | مایع شفاف | تغییر کم | واندروالس |
طعم و بوی اسید استیک
اسید استیک طعمی ترش و مشخصاً اسیدی دارد. این طعم نتیجه ی یون های هیدروژن (H⁺) آزاد شده در محلول آبی اسید استیک است که گیرنده های طعم ترشی را در زبان تحریک می کنند. شدت طعم ترش با افزایش غلظت اسید استیک افزایش می یابد. علاوه بر طعم ترش اسید استیک بوی تند و تیزی دارد که به طور قابل توجهی با غلظت آن ارتباط دارد. بوی اسید استیک در غلظت های پایین ملایم تر و در غلظت های بالا بسیار تند و زننده است. این ویژگی های حسی در خرید اسید استیک خوراکی برای صنایع غذایی جهت تهیه سرکه و چاشنی ها و همچنین در صنایع دارویی و آرایشی به عنوان یک جزء فعال یا نگهدارنده بسیار موثر می باشد. تغییرات در طعم و بوی اسید استیک ناشی از ناخالصی ها یا فرایندهای تولید متفاوت می باشند.
کشش سطحی و گرانروی اسید استیک
اسید استیک مانند بسیاری از مایعات کشش سطحی دارد ، نیرویی که سطح مایع را به حداقل می رساند. این خاصیت ناشی از برهم کنش های بین مولکولی به ویژه پیوندهای هیدروژنی بین مولکول های اسید استیک است. کشش سطحی بالا در اسید استیک بر رفتار آن در فرآیندهای صنعتی تاثیرگذار است. در فرآیندهای انتقال سیال کنترل کشش سطحی برای جلوگیری از تشکیل حباب ها و افزایش راندمان ضروری است. گرانروی اسید استیک ، مقاومت در برابر جریان مایع نیز به برهم کنش های بین مولکولی به ویژه پیوندهای هیدروژنی قوی بین مولکول ها مرتبط است. گرانروی اسید استیک در مقایسه با آب بیشتر است و این ویژگی در طراحی تجهیزات و فرآیندهای صنعتی نظیر پمپاژ و اختلاط اسید استیک مورد توجه قرار می گیرد. دقت در طراحی سیستم ها به منظور جبران گرانروی بالا برای جریان مناسب ضروری است. درک این خصوصیات برای بهینه سازی راندمان و به حداقل رساندن مصرف انرژی در فرایندهای صنعتی مهم است.
واکنش های شیمیایی اسید استیک
اسید استیک به عنوان یک اسید کربوکسیلیک در طیف گسترده ای از واکنش ها شرکت می کند. واکنش با بازها یک واکنش خنثی سازی اسید-باز کلاسیک را تشکیل می دهد که منجر به تشکیل نمک و آب می شود. واکنش اسید استیک با هیدروکسید سدیم ، استات سدیم و آب تولید می کند. واکنش با فلزات فعال مانند منیزیم یا روی منجر به تولید گاز هیدروژن و نمک مربوطه (استات فلزی) می شود. در این واکنش ها اسید استیک نقش اکسیدکننده را ایفا می کند و فلزات اکسید می شوند. واکنش های اسید استیک با ترکیبات آلی بسیار متنوع است. واکنش استریفیکاسیون با الکل ها به تولید استر و آب منجر می شود. این واکنش ها در سنتز بسیاری از ترکیبات آلی از جمله عطرها و طعم دهنده ها اهمیت بالایی دارند. همچنین اسید استیک در واکنش های آسیلاسیون با آمین ها شرکت می کند و آمید تولید می شود. رفتار اسید استیک در شرایط مختلف از جمله دمای واکنش ، غلظت واکنشگرها و حضور کاتالیزورها بر محصولات واکنش و سرعت آن تاثیر قابل توجهی دارد.
نقش اسید استیک در صنعت شیمیایی
اسید استیک ستون فقرات بسیاری از فرآیندهای شیمیایی صنعتی است. کاربرد اصلی آن در تولید پلی وینیل استات (PVAc) است که یک چسب و فیلم ساز مهم در صنایع رنگ ، چسب و نساجی محسوب می شود. اسید استیک در سنتز سلولز استات یک ماده اولیه در تولید الیاف مصنوعی مانند ریون و استات سلولز نیز نقش کلیدی ایفا می کند. این ماده در تولید مونومرهای وینیل استات و استرها مختلف که به عنوان حلال ، نرم کننده و افزودنی در محصولات مختلف استفاده می شوند ، به کار می رود. در صنعت پلاستیک اسید استیک در تولید پلی اتیلن ها و سایر پلیمرها نقش دارد. همچنین به عنوان یک واسطه در تولید ترکیبات شیمیایی دیگر مانند اسید استیک انیدرید و استات های فلزی استفاده می شود.
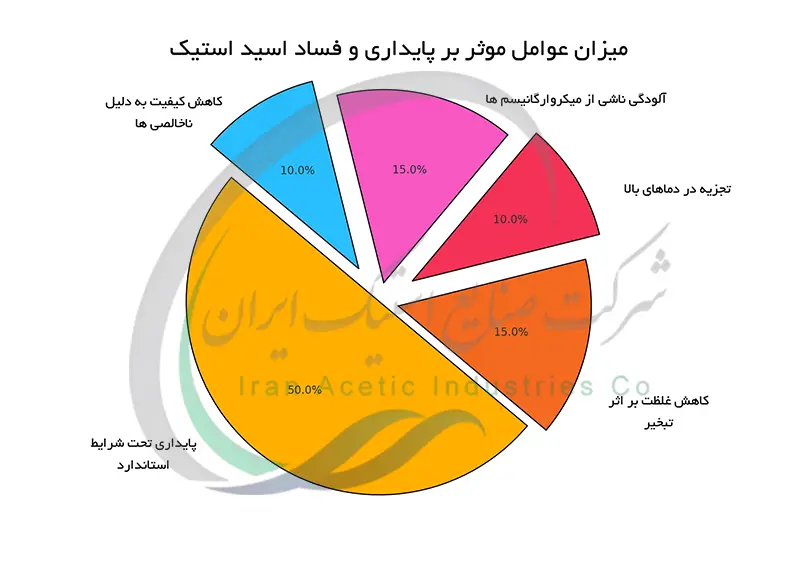
پایداری و فساد اسید استیک
اسید استیک به طور کلی یک ماده پایدار است اما تحت شرایط خاص دچار تغییر کیفیت می شود. قرارگیری در معرض دماهای بالا منجر به تبخیر و کاهش غلظت می شود. در دماهای بسیار بالا اسید استیک تجزیه شده و محصولات جانبی تشکیل می دهد. رطوبت بالا بر کیفیت آن تأثیر نمی گذارد اما می تواند به رشد میکروارگانیسم ها کمک کند ، که در صورت عدم کنترل باعث آلودگی و کاهش کیفیت اسید می شود. نگهداری در ظروف دربسته و در محیطی خنک و خشک از کاهش کیفیت اسید استیک جلوگیری می کند. وجود ناخالصی ها بر پایداری و کیفیت آن تأثیر منفی دارد. از این رو استفاده از اسید استیک با خلوص بالا برای اطمینان از عملکرد مطلوب در فرآیندهای صنعتی ضروری است.
اسید استیک در صنایع غذایی : کاربردها و مزایا
اسید استیک به عنوان ماده اصلی تشکیل دهنده سرکه نقش مهمی در صنایع غذایی دارد. سرکه با طعم ترش مشخص خود به عنوان چاشنی و نگهدارنده مواد غذایی عمل می کند. اسید استیک موجود در سرکه رشد باکتری ها و قارچ ها را مهار کرده و عمر مفید مواد غذایی را افزایش می دهد. این ماده همچنین به عنوان تنظیم کننده اسیدیته در تولید سس ها ، ترشیجات و دیگر محصولات غذایی کاربرد دارد. طعم و بوی مطلوب سرکه علاوه بر خاصیت نگهدارندگی آن عامل مهمی در افزایش جذابیت محصولات غذایی است.
مقایسه اسید استیک با سایر اسیدهای آلی
اسید استیک (CH₃COOH)، ساده ترین اسید کربوکسیلیک از نظر شیمیایی و فیزیکی با اسیدهای آلی دیگر مانند اسید فرمیک (HCOOH) و اسید پروپیونیک (CH₃CH₂COOH) متفاوت است. اسید فرمیک با یک اتم کربن نقطه جوش کمتری نسبت به اسید استیک دارد. اسید پروپیونیک با سه اتم کربن نقطه جوش بالاتری دارد. این تفاوت ها در نقطه جوش به دلیل تفاوت در جرم مولکولی و قدرت برهم کنش های بین مولکولی است. اسید استیک بوی تندی دارد که آن را از سایر اسیدها متمایز می کند. قدرت اسیدی اسید استیک بین اسید فرمیک قوی تر و اسید پروپیونیک ضعیف تر قرار می گیرد. این تفاوت در قدرت اسیدی به دلیل تأثیر گروه های آلکیل بر گروه کربوکسیل است.
استفاده از اسید استیک در پزشکی و داروسازی
اسید استیک در پزشکی و داروسازی کاربردهای متنوعی دارد. به عنوان ماده ضدعفونی کننده در ضدعفونی کردن پوست قبل از تزریق یا عمل جراحی استفاده می شود. غلظت های رقیق اسید استیک برای درمان عفونت های قارچی پوست نیز مؤثر است. در برخی داروها اسید استیک به عنوان یک جزء فعال یا کمک کننده در فرمولاسیون دارو مورد استفاده قرار می گیرد. اسید استیک به عنوان واسطه در سنتز برخی از داروها نیز نقش ایفا می کند. با این حال استفاده از اسید استیک در پزشکی باید با احتیاط و تحت نظر پزشک انجام شود زیرا در غلظت های بالا باعث تحریک پوست و مخاط می شود.





قدرت اسیدی اسید استیک در مقایسه با سایر اسیدها
نقطه جوش و نقطه انجماد اسید استیک
درجه خلوص های متداول اسید استیک