فهرست عناوین
- فرمول مولکولی اسید استیک (CH₃COOH) و ترکیب شیمیایی آن
- ساختار مولکولی اسید استیک و نحوه پیوندهای شیمیایی آن
- ویژگی های فیزیکی اسید استیک : از نقطه جوش تا انحلال پذیری
- قطبیت اسید استیک و تأثیر آن بر خاصیت حلالیت
- خاصیت اسیدی اسید استیک و درجه تفکیک آن در محلول آبی
- تشکیل پیوندهای هیدروژنی و تأثیر آن بر خواص فیزیکی اسید استیک
- اثر دما بر ساختار و پایداری مولکولی اسید استیک
- تأثیر اسید استیک بر تعادل شیمیایی و واکنش های اسیدی-بازی
- طیف سنجی و بررسی ساختار مولکولی اسید استیک
- مقایسه اسید استیک با دیگر اسیدهای کربوکسیلیک
- کاربردهای اسید استیک در صنعت و نقش آن در واکنش های شیمیایی
نوشته شده توسط شرکت صنایع استیک ایران
منتشر شده توسط شرکت صنایع استیک ایران
تاریخ انتشار مقاله : 18-11-1403
تاریخ بروزرسانی مقاله : 18-11-1403
تعداد کلمات : 1700
آدرس مقاله : لینک مقاله
فرمول مولکولی اسید استیک (CH3COOH) و خواص آن

فرمول مولکولی اسید استیک (CH₃COOH) و ترکیب شیمیایی آن
اسید استیک با فرمول مولکولی CH₃COOH یک ترکیب آلی از خانواده اسیدهای کربوکسیلیک و تفاوت ساختار اسید استیک با سایر اسیدهای آلی چشمگیر است. این ترکیب از یک گروه متیل (CH₃) متصل به یک گروه کربوکسیل (-COOH) تشکیل می شود. اتم کربن در گروه متیل توسط سه پیوند ساده به سه اتم هیدروژن متصل است در حالی که اتم کربن در گروه کربوکسیل با پیوند دوگانه به یک اتم اکسیژن و با پیوند ساده به یک گروه هیدروکسیل (-OH) پیوند دارد. وجود گروه کربوکسیل عامل اسیدی بودن اسید استیک است. و امکان آزادسازی یک پروتون (H⁺) در محلول آبی را فراهم می کند. این خاصیت اسیدی اسید استیک را در واکنش های خنثی سازی با بازها و همچنین واکنش های استری شدن فعال می کند. ویژگی های شیمیایی منحصر به فرد آن موجب کاربرد گسترده این ترکیب در صنایع شیمیایی و غذایی می شود.
ساختار مولکولی اسید استیک و نحوه پیوندهای شیمیایی آن
ساختار اسید استیک از پیوندهای کووالانسی بین اتم های کربن ، اکسیژن و هیدروژن تشکیل شده است. اتم کربن در گروه متیل (CH₃) از طریق سه پیوند σ با سه اتم هیدروژن پیوند دارد و با یک پیوند σ به اتم کربن گروه کربوکسیل (-COOH) متصل می شود. در گروه کربوکسیل اتم کربن با یک پیوند σ به گروه هیدروکسیل (-OH) و با یک پیوند π و یک پیوند σ به اتم اکسیژن دیگر (C=O) پیوند دارد. این پیوند دوگانه کربن-اکسیژن قطبی است و باعث ایجاد گشتاور دو قطبی در مولکول می شود. وجود گروه هیدروکسیل امکان تشکیل پیوندهای هیدروژنی بین مولکولی را فراهم می کند و بر خواص فیزیکی مانند نقطه جوش و حلالیت اسید استیک تأثیر می گذارد. هندسه مولکول در اطراف اتم های کربن تقریباً چهار دوجهی است در حالی که گروه کربوکسیل نسبتا مسطح است.
ویژگی های فیزیکی اسید استیک : از نقطه جوش تا انحلال پذیری
اسید استیک در شرایط استاندارد (دمای اتاق و فشار یک اتمسفر) مایعی بی رنگ و خورنده است که بوی تند و نافذی دارد. نقطه جوش آن 118 درجه سانتیگراد و نقطه انجماد آن 16.6 درجه سانتیگراد است. این نقطه جوش بالاتر از انتظار برای یک مولکول با جرم مولکولی مشابه ناشی از تشکیل پیوندهای هیدروژنی قوی بین مولکولهای اسید استیک است. این پیوندهای هیدروژنی همچنین به حلالیت قابل توجه آن در آب کمک می کنند. اسید استیک به راحتی در آب و بسیاری از حلال های قطبی آلی حل می شود در حالی که در حلال های غیر قطبی حلالیت کمتری دارد. انحلال پذیری بالای اسید استیک در آب به توانایی تشکیل پیوند هیدروژنی بین مولکول های اسید استیک و مولکول های آب مرتبط است. این پیوندها باعث یونیزاسیون جزئی اسید استیک در محلول های آبی می شوند که باعث خاصیت اسیدی آن می شود. اسید استیک در غلظت های بالا به صورت جامد کریستالی بی رنگ (اسید استیک یخی) تبلور می یابد.
قطبیت اسید استیک و تأثیر آن بر خاصیت حلالیت
ساختار مولکولی اسید استیک به ویژه گروه کربوکسیل (COOH) با پیوند قطبی کربن-اکسیژن و اکسیژن-هیدروژن باعث قطبیت بالای آن می شود. این قطبیت توانایی تشکیل پیوندهای هیدروژنی قوی با حلال های قطبی مانند آب را فراهم می آورد. در آب مولکول های اسید استیک از طریق پیوندهای هیدروژنی با مولکول های آب احاطه شده و به راحتی در آن حل می شوند. اتانول و استون نیز به عنوان حلال های قطبی با اسید استیک برهم کنش های بین مولکولی قوی برقرار می کنند. برعکس در حلال های غیرقطبی مانند بنزن و هگزان به دلیل فقدان برهم کنش های قابل توجه بین مولکول های اسید استیک و حلال ، حلالیت اسید استیک بسیار کم است. بنابراین حلالیت بالای اسید استیک در حلال های قطبی به طور مستقیم به قطبیت بالای ساختار مولکولی آن مرتبط است.
| ویژگی | توضیحات | قطبیت | حلالیت در آب | حلالیت در الکل | حلالیت در اتر | اثر بر دیگر مواد | کاربرد |
|---|---|---|---|---|---|---|---|
| قطبیت مولکولی | اسید استیک یک مولکول قطبی است به دلیل حضور گروه کربوکسیل (COOH) | بالا | زیاد | بالا | متوسط | قابلیت حل کردن ترکیبات قطبی | حلال در شیمی آلی |
| نوع پیوندهای بین مولکولی | دارای پیوندهای هیدروژنی و دو قطبی-دو قطبی | متوسط تا بالا | زیاد | بالا | متوسط | حل کردن ترکیبات آلی | صنایع غذایی |
| حلالیت در آب | بسیار محلول در آب به دلیل تشکیل پیوند هیدروژنی قوی | زیاد | کامل | زیاد | کم | ایجاد محلولهای آبی قوی | تولید دارو |
| حلالیت در حلالهای غیرقطبی | حلالیت کم در حلالهای غیرقطبی مانند هگزان | کم | کم | متوسط | متوسط | عدم حل شدن در هیدروکربنهای غیرقطبی | تصفیه مواد شیمیایی |
| قدرت اسیدی (pKa) | pKa حدود 4.76، که نشاندهنده قدرت اسیدی متوسط آن است | متوسط | متوسط | متوسط | متوسط | تأثیر بر pH محلول | تنظیم کننده pH |
| نقش گروه کربوکسیل | گروه کربوکسیل نقش کلیدی در افزایش قطبیت و حلالیت در آب دارد | بالا | زیاد | بالا | متوسط | تشکیل استرها با الکلها | استفاده در تولید استرها |
| تأثیر دما بر حلالیت | افزایش دما معمولاً باعث افزایش حلالیت اسید استیک در آب میشود | افزایش با دما | افزایش با دما | متغیر | کم تا متوسط | افزایش حلالیت در شرایط گرم | صنایع رنگ و رزین |
| کاربردهای حلالیتی | به عنوان حلال در صنایع داروسازی و شیمیایی استفاده میشود | متوسط تا بالا | مناسب | بالا | متوسط | مهم در تولید مواد شیمیایی | پاک کننده و ضدعفونی کننده |
خاصیت اسیدی اسید استیک و درجه تفکیک آن در محلول آبی
اسید استیک یک اسید مونوپروتونیک ضعیف است که در آب به طور کامل یونیزه نمی شود. ثابت تفکیک اسیدی (Ka) آن نشان دهنده تعادل بین مولکول های اسید استیک بدون تفکیک و یون های تشکیل شده استات (CH₃COO⁻) و هیدرونیوم (H₃O⁺) است. مقدار pKa برابر 4.76 نشانگر قدرت اسیدی نسبتاً ضعیف آن است. در محلول آبی رقیق تنها درصد کمی از مولکول های اسید استیک به یون های خود تفکیک می شوند. این ویژگی اسید استیک را به عنوان یک بافر مناسب در سیستم های بیولوژیکی مطرح می کند زیرا می تواند تغییرات ناگهانی pH را توسط جذب یا آزادسازی یون های هیدروژن خنثی کند. همچنین در واکنش های شیمیایی که نیاز به محیط اسیدی ملایم دارند کاربرد فراوانی دارد. این رفتار ضعیف اسیدی با ساختار رزونانسی گروه کربوکسیل قابل توجیه است.
تشکیل پیوندهای هیدروژنی و تأثیر آن بر خواص فیزیکی اسید استیک
گروه کربوکسیل در اسید استیک به دلیل حضور اتم اکسیژن الکترو منفی و اتم هیدروژن گروه هیدروکسیل توانایی تشکیل پیوندهای هیدروژنی قوی را دارد. این پیوندها بین مولکول های اسید استیک برقرار شده و منجر به تشکیل دایمرهای اسید استیک می شود که در آن دو مولکول اسید استیک از طریق پیوند هیدروژنی بین اتم اکسیژن گروه کربونیل یک مولکول و اتم هیدروژن گروه هیدروکسیل مولکول دیگر به هم متصل می شوند. این دایمرها پایداری مولکول های اسید استیک در فاز مایع را افزایش می دهند و نقطه جوش آن را به طور قابل توجهی بالا می برند (118 درجه سانتیگراد). پیوندهای هیدروژنی همچنین نقش مهمی در انحلال پذیری بالای اسید استیک در حلال های قطبی مانند آب دارد. در محلول های آبی پیوندهای هیدروژنی بین مولکول های اسید استیک و مولکول های آب نیز تشکیل می شود.
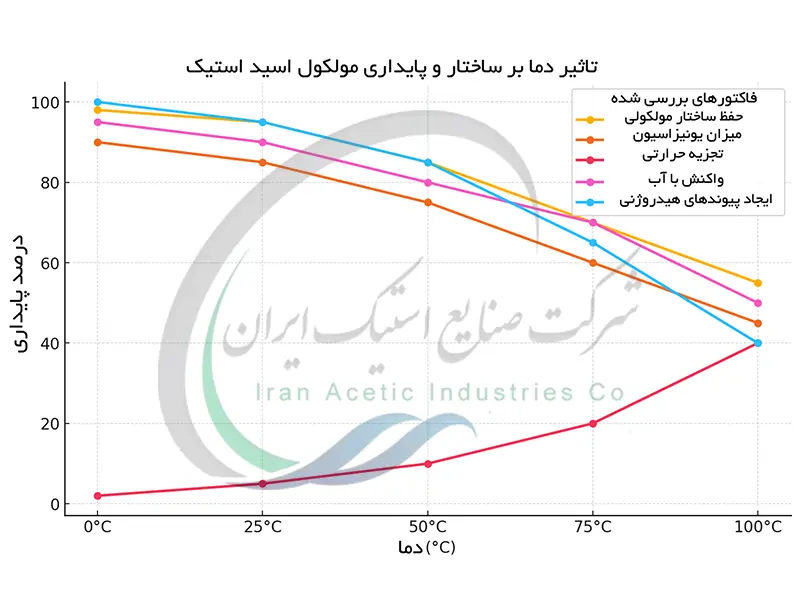
اثر دما بر ساختار و پایداری مولکولی اسید استیک
در دماهای پایین تر از نقطه انجماد (16.6 درجه سانتیگراد) اسید استیک به فرم جامد بلوری موسوم به اسید استیک یخی تبلور می یابد. در این حالت پیوندهای هیدروژنی قوی بین مولکول ها ، شبکه بلوری منظم و پایدار ایجاد می کنند. با افزایش دما انرژی جنبشی مولکول ها افزایش یافته و این پیوندهای هیدروژنی به تدریج ضعیف تر می شوند. نزدیک به نقطه ذوب حرکت مولکولی به حدی افزایش می یابد که شبکه بلوری فرو می پاشد و اسید استیک به حالت مایع در می آید. بالای نقطه جوش (118 درجه سانتیگراد) انرژی جنبشی به حدی زیاد می شود که نیروهای بین مولکولی به طور کامل شکسته شده و اسید استیک به بخار تبدیل می شود. در واقع با افزایش دما ساختار مرتب بلوری به ساختار بی نظم مایع و سپس به ساختار کاملاً بی نظم گازی تبدیل می گردد. این تغییرات فیزیکی نشانگر حساسیت ساختار مولکولی اسید استیک به دما است.
تأثیر اسید استیک بر تعادل شیمیایی و واکنش های اسیدی-بازی
توانایی اسید استیک در اهدای یک پروتون (H⁺) به بازها اساس بسیاری از واکنش ها را تشکیل می دهد. در واکنش با بازهای قوی مانند هیدروکسید سدیم (NaOH) تعادل به سمت تشکیل نمک استات سدیم (CH₃COONa) و آب جابجا می شود. قدرت اسیدی اسید استیک با ثابت تفکیک اسیدی (Ka) مشخص می شود که نشان دهنده میزان یونیزاسیون آن در محلول آبی است. این خاصیت اسید استیک را در تنظیم pH محلول ها مفید می کند. استفاده از اسید استیک در واکنش های خنثی سازی موجب تولید نمک های استات متنوعی می شود که کاربردهای صنعتی و دارویی متعددی دارند. به عنوان مثال استات سلولز در تولید فیلم عکاسی و استات های فلزی در صنایع مختلف به کار می روند. کنترل دقیق pH به کمک اسید استیک در بسیاری از فرایندهای شیمیایی و بیوشیمیایی از اهمیت بالایی برخوردار است.
طیف سنجی و بررسی ساختار مولکولی اسید استیک
طیف سنجی مادون قرمز (IR) و رزونانس مغناطیسی هسته ای (NMR) ابزارهای قدرتمندی برای تعیین ساختار مولکولی اسید استیک هستند. طیف IR حضور گروه عاملی کربوکسیل را با نوارهای جذب مشخص برای پیوندهای O- H کششی وسیع در محدوده 3300-2500 cm⁻¹ و C=O نوار قوی و تیز در حدود 1700 cm⁻¹ تایید می کند. وجود پیوند هیدروژنی بین مولکولی در طیف IR با پهن شدن نوار جذب O-H قابل مشاهده است. طیف ¹H NMR سیگنال های مجزایی برای پروتون های گروه متیل (CH₃) به صورت یک سینگلت و برای پروتون اسیدی گروه کربوکسیل (COOH) به صورت یک سینگلت (که در محلول های آبی به دلیل تبادل پروتون ممکن است به طور کامل دیده نشود) نشان می دهد. طیف 13 C NMR نیز اطلاعاتی در مورد محیط شیمیایی اتم های کربن مختلف در مولکول ارائه می دهد. ترکیب این اطلاعات طیف سنجی تایید دقیقی از ساختار CH₃COOH را فراهم می کند. تجزیه و تحلیل جابجایی های شیمیایی و ثابت های جفت شدگی جزئیات بیشتری در مورد محیط الکترونی پیرامون اتم ها ارائه می دهد.
مقایسه اسید استیک با دیگر اسیدهای کربوکسیلیک
اسید استیک ، اسید فرمیک و اسید پروپیونیک سه عضو از خانواده اسیدهای کربوکسیلیک هستند. اسیدیته این ترکیبات با طول زنجیره آلکیل تغییر می کند ، اسید فرمیک قوی ترین و اسید پروپیونیک ضعیف تر از اسید استیک است. افزودن گروه های آلکیل به گروه کربوکسیل اثر القایی الکترون دهنده ایجاد کرده که چگالی الکترون اطراف گروه کربوکسیل را افزایش می دهد و در نتیجه قدرت اسیدی را کاهش می دهد. این تفاوت در اسیدیته بر خواص دیگر مانند حلالیت و نقطه جوش نیز تاثیر می گذارد. اسید استیک به دلیل وجود گروه متیل نقطه جوش بالاتری نسبت به اسید فرمیک دارد اما نقطه جوش کمتری نسبت به اسید پروپیونیک. حلالیت این ترکیبات در آب نیز با افزایش طول زنجیره آلکیل کاهش می یابد.
کاربردهای اسید استیک در صنعت و نقش آن در واکنش های شیمیایی
به عنوان یک واسطه شیمیایی در سنتز بسیاری از ترکیبات آلی مانند استات سلولز (در تولید فیلم عکاسی ، الیاف و پوشش ها) ، پلی وینیل استات (در تولید چسب و رنگ) و انواع استرها (در تولید عطرها و طعم دهنده ها) بهکار می رود. خرید اسید استیک در صنعت نساجی برای چاپ و رنگرزی پارچهها صورت می گیرد. و در صنایع غذایی به عنوان چاشنی و نگهدارنده (به ویژه در سرکه) کاربرد دارد. در داروسازی نیز به عنوان پیش ماده در سنتز برخی داروها و همچنین به عنوان یک ضدعفونی کننده مورد استفاده قرار می گیرد. واکنش های شیمیایی اسید استیک اغلب شامل واکنش های اسید-باز ، استری شدن و تشکیل انیدرید استیک است. در واکنش های استری شدن با الکل ها ترکیب شده و استرها را تولید می کند. انیدرید استیک یک ترکیب بسیار واکنش پذیر است که در سنتزهای آلی نقش مهمی دارد. کاربردهای گسترده اسید استیک به ویژگی های منحصر به فرد آن مانند اسیدیته متوسط ، قیمت پایین و قابلیت دسترسی مربوط می شود.




