فهرست عناوین
- مقدمه ای بر قدرت اسیدی اسید استیک
- تعریف قدرت اسیدی و تأثیر آن بر رفتار شیمیایی
- مقایسه قدرت اسیدی اسید استیک با اسیدهای ضعیف دیگر
- قدرت اسیدی اسید استیک در مقایسه با اسیدهای قوی
- رابطه بین ساختار مولکولی و قدرت اسیدی اسید استیک
- تأثیر دما بر قدرت اسیدی اسید استیک
- اثر غلظت و غلظت های مختلف بر قدرت اسیدی اسید استیک
- چگونگی اندازه گیری قدرت اسیدی اسید استیک
- تأثیر محیط بر قدرت اسیدی اسید استیک و سایر اسیدها
- قدرت اسیدی اسید استیک در واکنش های صنعتی
- اسید استیک و اسیدهای آلی دیگر : تفاوت ها و شباهت ها در قدرت اسیدی
نوشته شده توسط شرکت صنایع استیک ایران
منتشر شده توسط شرکت صنایع استیک ایران
تاریخ انتشار مقاله : 26-11-1403
تاریخ بروزرسانی مقاله : 26-11-1403
تعداد کلمات : 1600
آدرس مقاله : لینک مقاله
قدرت اسیدی اسید استیک در مقایسه با سایر اسیدها

مقدمه ای بر قدرت اسیدی اسید استیک
اسید استیک (CH₃COOH) یک اسید کربوکسیلیک ساده با کاربردهای فراوان در صنایع غذایی ، دارویی و شیمیایی است. این اسید جزء اصلی سرکه بوده و به دلیل طعم و خاصیت ضد باکتریایی شناخته می شود. قدرت اسیدی توانایی یک اسید در آزادسازی یون هیدروژن (H⁺) در محلول آبی را نشان می دهد. اسیدهای قوی به طور کامل به یون های خود تفکیک می شوند در حالی که اسیدهای ضعیف فقط به صورت جزئی تفکیک می شوند. اندازه گیری قدرت اسیدی با استفاده از ثابت تفکیک اسیدی (Ka) یا pKa انجام می شود. Ka نشان دهنده نسبت غلظت یون های حاصل از تفکیک به غلظت اسید بدون تفکیک است. pKaمنفی لگاریتم Ka است. مقدار pKa پایین تر نشان دهنده قدرت اسیدی بالاتر است. اسید استیک یک اسید ضعیف با pKa حدود 4.76 است.
تعریف قدرت اسیدی و تأثیر آن بر رفتار شیمیایی
قدرت اسیدی اندازه ای از تمایل یک اسید به از دست دادن پروتون (H⁺) است. اسیدهای قوی پروتون خود را به راحتی از دست می دهند و به طور کامل در آب تفکیک می شوند. اسیدهای ضعیف به طور جزئی تفکیک می شوند و تعادل بین اسید و یون های تشکیل شده برقرار است. ثابت تفکیک اسیدی (Ka) معیاری کمی برای قدرت اسیدی است. Ka بزرگ تر نشان دهنده قدرت اسیدی بیشتر است. قدرت اسیدی بر واکنش پذیری اسید ، PH محلول و توانایی آن در واکنش با بازها و نقطه جوش و نقطه انجماد اسید استیک ، تأثیر مستقیم دارد. اسیدهای قوی تر در واکنش های اسید-باز سریع تر و کامل تر شرکت می کنند.
مقایسه قدرت اسیدی اسید استیک با اسیدهای ضعیف دیگر
اسید استیک یک اسید ضعیف محسوب می شود. قدرت اسیدی آن با اسیدهای ضعیف دیگر مانند اسید فرمیک (HCOOH) و اسید لاکتیک (CH₃CH(OH)COOH) قابل مقایسه است. اسید فرمیک قدرت اسیدی قوی تری نسبت به اسید استیک دارد pKa حدود 3.75 . این به دلیل گروه فرمیل کوچکتر و اثر القایی قوی تر آن است که باعث افزایش پایداری آنیون فرمات نسبت به آنیون استات می شود. اسید لاکتیک قدرت اسیدی ضعیف تری از اسید استیک دارد pKa حدود 3.86 . گروه هیدروکسیل در اسید لاکتیک با ایجاد پیوند هیدروژنی پایداری آنیون لاکتات را کاهش می دهد. در محیط آبی این تفاوت در قدرت اسیدی بر رفتار شیمیایی این اسیدها از جمله واکنش پذیری با بازها و PH محلول های آنها تأثیر می گذارد. محلول های با غلظت یکسان PH متفاوتی خواهند داشت.
| نام اسید | فرمول شیمیایی | pH محلول 1 مولار | قدرت اسیدی (Ka) | نوع اسید | کاربرد رایج |
|---|---|---|---|---|---|
| اسید استیک | CH3COOH | 2.4 | 1.75×10⁻⁵ | ضعیف | سرکه و مواد نگهدارنده |
| اسید فسفریک | H3PO4 | 2.1 | 7.08×10⁻³ | ضعیف | کودهای شیمیایی، نوشیدنیها |
| اسید کربنیک | H2CO3 | 3.6 | 4.3×10⁻⁷ | ضعیف | نوشیدنیهای گازدار |
| اسید سیتریک | C6H8O7 | 2.2 | 7.4×10⁻⁴ | ضعیف | مواد نگهدارنده، صنایع غذایی |
| اسید بوریک | H3BO3 | 5.1 | 5.8×10⁻¹⁰ | ضعیف | صنایع دارویی، ضدعفونیکننده |
| اسید لاکتیک | C3H6O3 | 2.4 | 1.38×10⁻⁴ | ضعیف | محصولات لبنی، آرایشی |
| اسید مالیک | C4H6O5 | 2.2 | 4.07×10⁻⁴ | ضعیف | مواد نگهدارنده، صنایع غذایی |
قدرت اسیدی اسید استیک در مقایسه با اسیدهای قوی
اسید استیک اسیدی ضعیف با ثابت تفکیک اسیدی (Ka) کوچک است در حالی که اسیدهای قوی مانند کلریدریک (HCl) و سولفوریک (H₂SO₄) دارای Ka بسیار بزرگ هستند. اسیدهای قوی در آب تقریباً به طور کامل به یون های تشکیل دهنده خود تفکیک می شوند اما اسید استیک فقط جزئی تفکیک می یابد. این تفاوت به ساختار مولکولی برمی گردد. پیوند O-H در اسید استیک قوی تر از پیوند مشابه در اسیدهای قوی است. پس از ، از دست دادن پروتون آنیون استات (CH₃COO⁻) تشکیل می شود که به دلیل پایداری نسبتا کمتر تمایل به گرفتن مجدد پروتون دارد. اسیدهای قوی آنیون های پایدارتری تشکیل می دهند که تمایل کمتری به جذب مجدد پروتون دارند. در نتیجه اسیدهای قوی واکنش پذیری بسیار بالاتری در مقایسه با اسید استیک در واکنش های اسید-باز نشان می دهند. واکنش اسید استیک با فلزات کندتر و ناقص تر از واکنش اسیدهای قوی است.
رابطه بین ساختار مولکولی و قدرت اسیدی اسید استیک
قدرت اسیدی اسید استیک از گروه عاملی کربوکسیل (COOH) آن ناشی می شود. اتم اکسیژن الکترونگاتیو چگالی الکترون پیوند O-H را کاهش می دهد که پروتون را مستعد جدایش می کند. پایداری آنیون استات (CH₃COO⁻) پس از جدایش پروتون در قدرت اسیدی اسید استیک نقش اساسی دارد. ساختار رزونانسی آنیون استات بار منفی را بین دو اتم اکسیژن توزیع می کند و پایداری آن را افزایش می دهد. با این حال گروه متیل (CH₃) اثر القایی اندکی دارد به همین دلیل پایداری آنیون به طور کامل بالا نیست. در مقایسه با سایر اسیدهای کربوکسیلیک وجود گروه های الکترون کشنده در نزدیکی گروه کربوکسیل قدرت اسیدی را افزایش می دهد در حالی که گروه های الکترون دهنده آن را کاهش می دهند. بنابراین ساختار اسید استیک سبب قدرت اسیدی متوسط آن می شود.
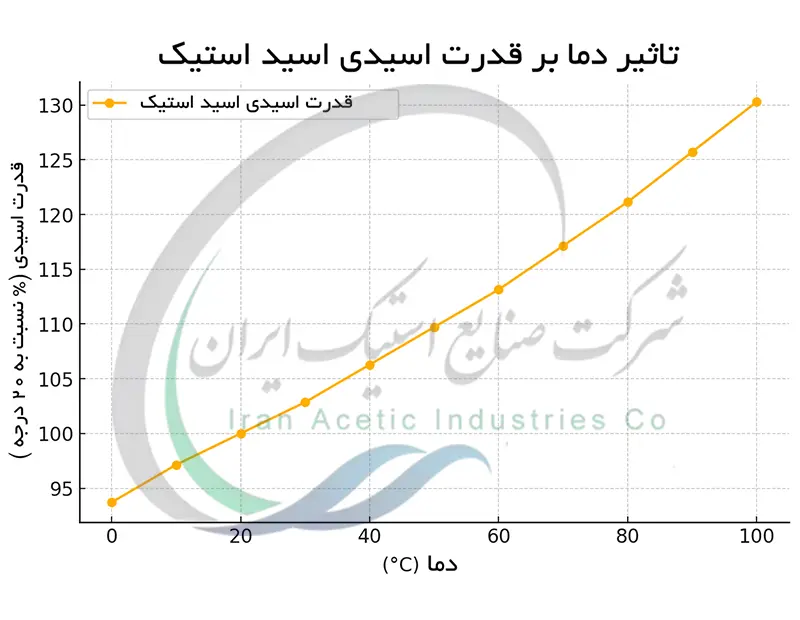
تأثیر دما بر قدرت اسیدی اسید استیک
افزایش دما قدرت اسیدی اسید استیک را اندکی افزایش می دهد. این افزایش ناشی از تغییر ثابت تفکیک اسیدی (Ka) با دماست. با افزایش دما تفکیک اسید استیک به یون های استات و هیدرونیوم بیشتر می شود و در نتیجه PH محلول کاهش می یابد. این تغییر در Ka در مقایسه با اسیدهای قوی کمتر محسوس است. اسیدهای قوی تقریباً به طور کامل تفکیک می شوند و تغییر دما تأثیر چندانی بر میزان تفکیک آن ها ندارد. در مقابل اسید استیک به عنوان یک اسید ضعیف ، به دما حساس تر است اما این حساسیت هنوز جزئی است. این تفاوت در رفتار اسیدهای قوی و ضعیف در برابر دما به پایداری نسبی یون هایشان پس از تفکیک مربوط می شود. آنیونهای حاصل از تفکیک اسیدهای قوی بسیار پایدارتر از آنیون استات هستند و بنابراین تغییر دما تأثیر کمتری روی آن ها دارد.
اثر غلظت و غلظت های مختلف بر قدرت اسیدی اسید استیک
غلظت اسید استیک در محلول آبی به طور مستقیم بر قدرت اسیدی آن تأثیر می گذارد. افزایش غلظت سبب افزایش غلظت یون های هیدرونیوم (H₃O⁺) می شود و PH محلول را کاهش می دهد. بنابراین اسید استیک غلیظتر اسیدی تر است. حتی در غلظت های بالا اسید استیک همچنان یک اسید ضعیف باقی می ماند و به طور کامل تفکیک نمی شود. اسیدهای قوی حتی در غلظت های بسیار رقیق قدرت اسیدی بالایی را نشان می دهند. این به دلیل تفکیک کامل آن هاست. در مقایسه قدرت اسیدی اسید استیک با رقیق شدن محلول به طور قابل توجهی کاهش می یابد. این تفاوت به دلیل تفاوت در ثابت تفکیک اسیدی (Ka) اسیدهای قوی و ضعیف است.
چگونگی اندازه گیری قدرت اسیدی اسید استیک
اندازه گیری قدرت اسیدی اسید استیک از روش های مختلفی قابل انجام است. یکی از رایج ترین روش ها استفاده از PH متر است. PH متر غلظت یون های هیدرونیوم را در محلول اندازهگیری می کند و PH را نشان می دهد. PH پایین تر نشان دهنده قدرت اسیدی بیشتر است. با اندازه گیری PH محلول های اسید استیک با غلظت های مختلف می توان قدرت اسیدی آن را تعیین کرد. روش دیگر تیتراسیون اسید-باز است. در این روش محلول اسید استیک با محلول باز قوی (مانند هیدروکسید سدیم) تیتر می شود تا نقطه هم ارزی تعیین شود. از حجم و غلظت باز مصرف شده در تیتراسیون می توان غلظت اسید استیک و در نتیجه قدرت اسیدی آن را محاسبه کرد. در مقایسه با اسیدهای قوی نقطه هم ارزی در تیتراسیون اسید استیک به وضوح مشخص تر نیست. از روش های طیف سنجی برای تعیین قدرت اسیدی استفاده می شود. این روش ها به طور دقیق تر Ka را بدست می آورند.
تأثیر محیط بر قدرت اسیدی اسید استیک و سایر اسیدها
محیط عامل مهمی در تعیین قدرت اسیدی اسید استیک و سایر اسیدهاست. حلال های مختلف ثابت تفکیک اسیدی (Ka) را تغییر می دهند. در حلال های قطبی تفکیک اسید افزایش و قدرت اسیدی بیشتر می شود. افزودن بازها با خنثی سازی بخشی از اسید قدرت اسیدی را کاهش می دهد. این اثر در اسیدهای قوی کمتر محسوس است زیرا این اسیدها به طور کامل تفکیک می شوند. در مقابل در اسیدهای ضعیف مانند اسید استیک تغییر در محیط تأثیر قابل توجهی بر میزان تفکیک و قدرت اسیدی دارد. وجود یون های مشترک نیز بر قدرت اسیدی اسید استیک تأثیر می گذارد. برای مثال وجود یون استات تفکیک اسید استیک را کاهش می دهد. این اثر، اثر یون مشترک نامیده می شود.
قدرت اسیدی اسید استیک در واکنش های صنعتی
در تولید استرها اسید استیک به عنوان عامل اسیدی عمل می کند. این واکنش برای تولید استات های مختلف از جمله استات سلولز (ماده ای در تولید فیلم و الیاف) و استات های مختلف به عنوان حلال یا طعم دهنده استفاده می شود. در صنعت مواد غذایی از اسید استیک به عنوان تنظیم کننده اسیدیته و نگهدارنده استفاده می شود. قدرت اسیدی ملایم آن به طعم و ماندگاری مواد غذایی کمک می کند. در تولید مواد شیمیایی اسید استیک در تولید وینیل استات (مونومر برای تولید چسب و رنگ) و اسید سیتریک نقش دارد. در صنعت نساجی از آن برای تولید رنگ ها و پرداخت پارچه ها استفاده می شود. قدرت اسیدی قابل کنترل اسید استیک باعث شده تا در بسیاری از فرآیندهای صنعتی به عنوان یک کاتالیزور ملایم مورد استفاده قرار گیرد. کنترل قدرت اسیدی آن در این فرآیندها بسیار مهم است.
اسید استیک و اسیدهای آلی دیگر : تفاوت ها و شباهت ها در قدرت اسیدی
اسید استیک یک اسید کربوکسیلیک ضعیف است. قدرت اسیدی آن به گروه کربوکسیل (-COOH) مربوط است که توانایی آزاد کردن پروتون (H⁺) را دارد. اسیدهای آلی دیگر مانند اسید سیتریک و اسید بوتانوئیک نیز دارای گروه کربوکسیل هستند اما قدرت اسیدی متفاوتی دارند. اسید سیتریک به دلیل داشتن سه گروه کربوکسیل اسیدی تر از اسید استیک است. گروه های کربوکسیل با اثر القایی و رزونانس بر قدرت اسیدی تأثیر می گذارند. در اسید سیتریک اثر القایی گروههای کربوکسیل بر یکدیگر قدرت اسیدی را افزایش می دهد. در اسید بوتانوئیک گروه آلکیل (بوتیل) اثر القایی الکترون دهنده دارد و قدرت اسیدی را نسبت به اسید استیک کاهش می دهد. عوامل دیگری مانند اندازه گروه آلکیل و وجود گروه های عاملی دیگر در مولکول نیز بر قدرت اسیدی تأثیر دارند.




