فهرست عناوین
- مقدمه
- تکامل فناوری های تولید اسید استیک
- کربونیلاسیون متانول : فرآیندهای مونسانتو و کاتیوا
- کاتالیست ناهمگن در سنتز اسید استیک
- مسیرهای بیوتکنولوژیک تولید اسید استیک
- تخمیر گاز سنتز و گازهای صنعتی
- تولید الکتروشیمیایی اسید استیک از CO₂
- مسیرهای فتوکاتالیستی و خورشیدی
- تبدیل مستقیم متان به اسید استیک
- مسیرهای اکسایشی : اتان ، اتانول و دیگر خوراک ها
- بازیافت کربن : استفاده از CO₂ در تولید اسید استیک
- مقایسه روش های سنتی و نوظهور تولید اسید استیک
نوشته شده توسط شرکت صنایع استیک ایران
منتشر شده توسط شرکت صنایع استیک ایران
تاریخ انتشار مقاله : 13-05-1404
تاریخ بروزرسانی مقاله : 13-05-1404
تعداد کلمات : 2600
آدرس مقاله : لینک مقاله
فناوری های پیشرفته و نوین در تولید اسید استیک

مقدمه
اسید استیک یک ماده شیمیایی پایه و بسیار مهم است که در تولید پلیمرها ، حلال ها و سرکه به کار می رود. تقاضای جهانی اسید استیک سال به سال در حال افزایش هستند و این امر علاقه به روش های کارآمدتر تولید را برانگیخته است. به طور سنتی ، عمده اسید استیک از خوراک های فسیلی و از طریق فرآیندهای تثبیت شده تولید می شده است. اما امروزه فناوری های پیشرفته و نوآورانه ای در حال ظهور هستند تا تولید اسید استیک پایدارتر ، اقتصادی تر و متنوع تر شود.
تکامل فناوری های تولید اسید استیک
اسید استیک در طول تاریخ به روش های مختلفی تولید شده است. در ابتدا تولید این ماده عمدتا به روش های زیستی مانند تخمیر سرکه از الکل حاصل از میوه ها یا غلات توسط باکتری ها انجام می شد. در قرن نوزدهم تقطیر تخریبی چوب (اسید چوب) به عنوان منبع دیگری از اسید استیک مطرح شد. قرن بیستم شاهد ظهور روش های پتروشیمیایی بود ؛ اکسیداسیون استالدئید ، هیدروکربن های سبک مانند بوتان و واکنش مستقیم استیلن با آب نمونه هایی از این روش ها بودند. اما تحول اصلی در اواخر دهه ۱۹۶۰ با کربونیلاسیون متانول رخ داد که امروزه روش غالب صنعتی محسوب می شود. خرید اسید استیک شازند گالن 20 لیتری یکی از گزینه های محبوب برای تامین این ماده در بازارهای داخلی است. پیشرفت های مستمر در فناوری ، کاتالیست ها و طراحی فرایند منجر به افزایش چشمگیر بازده شده است و تلاش ها برای دستیابی به روش های پایدار و با اثرات زیست محیطی کمتر همچنان ادامه دارد.
کربونیلاسیون متانول : فرآیندهای مونسانتو و کاتیوا
معرفی فرآیند کربونیلاسیون متانول، شیوه تولید اسید استیک را به طور اساسی دگرگون کرد. در این فرآیند ، متانول و مونوکسید کربن در حضور یک کاتالیست فلزی محلول واکنش داده و در یک مرحله به اسید استیک تبدیل می شوند. فرآیند مونسانتو که در دهه ۱۹۶۰ توسعه یافت ، از یک کاتالیست رودیوم همراه با کمکعامل یدید متیل (یدور متیل) تحت فشار بالا استفاده می کند. این روش بازده و گزینش پذیری بسیار بالایی نشان داد (نزدیک به ۹۹٪) و تولید اسید استیک را به مراتب اقتصادی تر از روش های پیشین کرد. در دهه ۱۹۹۰ شرکت BP فرآیند بهبود یافته کاتیوا را معرفی کرد که در آن به جای رودیوم از کاتالیست ایریدیوم به همراه افزودنی های مخصوص استفاده می شود. فرآیند کاتیوا پایداری و بهره وری بالاتری دارد و به دلیل عملکرد در غلظت آب کمتر ، تشکیل محصولات جانبی ناخواسته و خورندگی را کاهش می دهد. هر دو فرآیند مونسانتو و کاتیوا ستون فقرات صنعت اسید استیک هستند و بیشتر تولید جهانی را به خود اختصاص داده اند. این روش ها نشان داده است که چگونه کاتالیست های پیشرفته می توانند هزینه ها را به شدت کاهش داده و بازده را افزایش دهند.
کاتالیست ناهمگن در سنتز اسید استیک
دانشمندان برای بهبود تولید اسید استیک به دنبال استفاده از کاتالیست های ناهمگن (جامد) هستند که برخلاف کاتالیست های مایع متداول (فرآیند مونسانتو/کاتیوا) ، در مخلوط واکنش حل نمی شوند. این کاتالیست ها جداسازی محصول را ساده تر کرده و مشکلات خوردگی را کاهش می دهند. به عنوان نمونه زئولیت ها و اکسیدهای فلزی در کربونیلاسیون گازی متانول و دی متیل اتر آزمایش شده و توانسته اند اسید استیک یا استات متیل را با گزینش پذیری مطلوب تولید کنند. مزیت مهم کاتالیست های جامد سهولت جداسازی و امکان استفاده از فلزات ارزان تر است ، اما نرخ تبدیل پایین تر و غیرفعال شدن تدریجی هنوز چالش هایی جدی هستند. نوآوری هایی مانند استفاده از کمککننده ها یا حامل های نوین (مانند چارچوب های فلزی-آلی (MOF)) در حال توسعه است تا عملکرد کاتالیست های جامد را به سطح کاتالیست های رودیوم و ایریدیوم نزدیک کند.
مسیرهای بیوتکنولوژیک تولید اسید استیک
فناوری زیستی برای تولید اسید استیک از فرایندهای زیستی مانند تخمیر سرکه توسط باکتری های اسید استیک (Acetobacter و Gluconobacter) استفاده می کند که اتانول را در شرایط هوازی به اسید استیک تبدیل می کنند. محدودیت طبیعی این باکتری ها غلظت پایین محصول (۱۰ تا ۱۵ درصد) است که با مهندسی ژنتیک و روش هایی مانند تخمیر پیوسته با حذف محصول (مثلا جداسازی غشایی یا استخراج) برطرف می شود. این فرایندها زیست توده تجدیدپذیر مصرف می کنند و با اصول شیمی سبز همخوانی دارند ، اما سرعت واکنش پایین و غلظت رقیق محصول کاربرد آنها را به موارد خاص محدود کرده است. پیشرفت در مهندسی متابولیک و طراحی فرایند ممکن است در آینده نقش آنها را در صنعت گسترش دهد.
تخمیر گاز سنتز و گازهای صنعتی
تخمیر گاز یک مسیر نوآورانه زیستی برای تولید اسید استیک است که توسط باکتری های بی هوازی استوژن انجام می شود. این میکروب ها گاز سنتز (شامل CO، CO₂ و H₂ حاصل از گازی سازی زیست توده یا گازهای زائد صنعتی) را از طریق مسیر وود-لیونگدال به اسید استیک تبدیل می کنند. مزیت کلیدی این روش امکان استفاده از جریان های گازی زائد صنعتی مانند گاز خروجی کارخانه های فولاد و پالایشگاه ها است، که علاوه بر تولید اسید استیک به کاهش انتشار گازهای گلخانه ای از طریق تثبیت CO₂ کمک می کند. فرآیند تخمیر گاز معمولا در راکتورهای ستونی حباب دار یا مخازن همزن دار انجام می شود که گاز به محیط حاوی باکتری ها تزریق می شود. از چالش های مهم ، انتقال و انحلال موثر گاز در محیط مایع و غلظت پایین محصول نهایی است. با این وجود این مسیر به عنوان روشی پایدار و امیدوارکننده برای تولید صنعتی اسید استیک در حال توسعه است.
تولید الکتروشیمیایی اسید استیک از CO₂
تبدیل الکتروشیمیایی دی اکسید کربن (CO₂) روشی نوین برای تولید اسید استیک است که با کمک انرژی الکتریکی و کاتالیست هایی مانند مس انجام می شود. در این فرایند CO₂ که از منابعی مانند دودکش های صنعتی یا هوای مستقیم جذب می شود. به ترکیبات کربنی چند اتمی مثل یون استات (فرم یونی اسید استیک) تبدیل می گردد. تحقیقات اخیر نشان داده اند که سلول های الکتروشیمیایی پیوسته قادر به تولید مستقیم اسید استیک خالص از گاز CO هستند.
مسیرهای فتوکاتالیستی و خورشیدی
تولید فتوکاتالیستی اسید استیک روشی نوآورانه است که از نور خورشید یا نور مصنوعی برای پیشبرد واکنش های شیمیایی بهره می برد. در این فرآیند ، فتوکاتالیست هایی مانند نیمهرساناهای اصلاح شده (مثل دی اکسید تیتانیوم) یا نانوساختارهای خاص ، انرژی نوری را جذب کرده و برای تبدیل دی اکسید کربن و آب به اسید استیک استفاده می کنند. پژوهش ها نشان داده اند که برخی کاتالیست های آزمایشی می توانند مقادیر اندکی اسید استیک یا پیش ماده های آن را از CO₂ و آب تولید کنند ، هرچند بازده فعلی بسیار پایین است. همچنین واکنش هایی با استفاده همزمان از متان و CO₂ تحت نور برای تشکیل مستقیم اسید استیک بررسی شده است. با وجود جذابیت بالای این روش از نظر پایداری و استفاده از انرژی پاک ، تولید فتوکاتالیستی اسید استیک همچنان در مراحل اولیه است و نیازمند پیشرفت در افزایش بازده ، بهبود کاتالیست ها و طراحی راکتورهای مناسب است.
تبدیل مستقیم متان به اسید استیک
تبدیل مستقیم متان به اسید استیک رویکردی نویدبخش و پربازده است که می تواند نیاز به مراحل میانی مثل تولید متانول یا گاز سنتز را حذف کرده و صرفه جویی چشمگیری در انرژی و هزینه ایجاد کند. اخیرا کربونیلاسیون اکسایشی متان با استفاده از اکسیژن و مونوکسیدکربن بر روی کاتالیست های پیشرفته موفقیت آمیز بوده و گزینش پذیری بیش از ۹۰٪ در شرایط ملایم گزارش شده است. کاتالیست های دوسایته که همزمان متان و CO را فعال می کنند ، نشان داده اند که طراحی پیشرفته کاتالیست می تواند منجر به واکنش هایی با بازده بالا شود. فرآیند اکسیداسیون استالدئید برای تولید اسید استیک نیز یکی از روش های اثبات شده و پرکاربرد در صنعت است. روش های دیگری مانند استفاده از اکسنده های قوی ، انرژی فوتوشیمیایی و پلاسما نیز در حال بررسی هستند. با این حال فعال سازی متان همچنان دشوار بوده و دوام کاتالیست ها و انتقال فناوری از مقیاس آزمایشگاهی به صنعتی چالش برانگیز است. حل این مشکلات می تواند به یک نوآوری انقلابی در صنعت شیمیایی منجر شود.
مسیرهای اکسایشی : اتان ، اتانول و دیگر خوراک ها
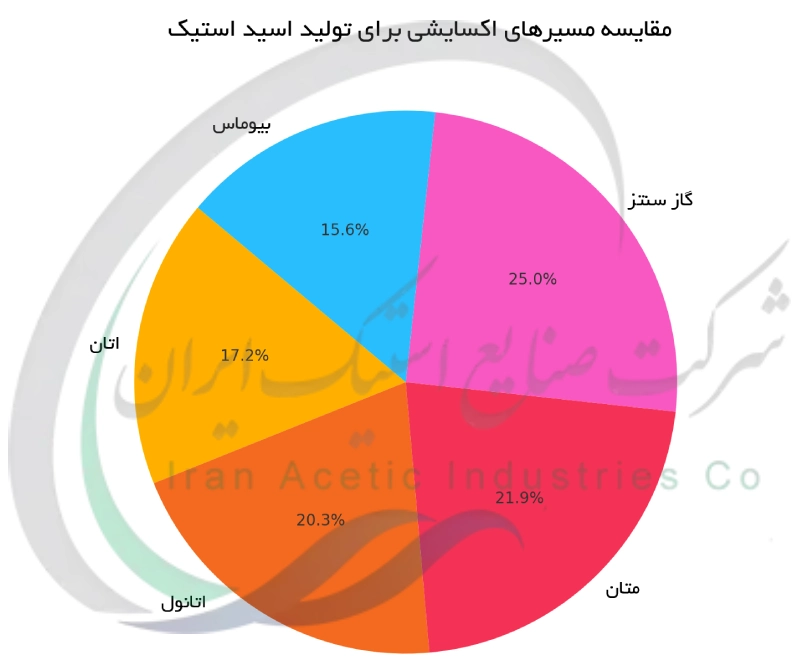
علاوه بر متان ، خوراک های دیگری نیز می توانند به صورت مستقیم و از طریق شیمی خلاقانه به اسید استیک اکسید شوند. برای نمونه اتان یک آلکان دوکربنه است که پژوهشگران آن را برای اکسیداسیون جزئی به اسید استیک هدف قرار داده اند. با استفاده از کاتالیست های ویژه و اکسیژن از لحاظ نظری می توان اتان را تنها در یک مرحله به اسید استیک تبدیل کرد. برخی تحقیقات آزمایشگاهی این واکنش را با بازده متوسط انجام داده اند که نشان می دهد مایعات گازی ارزان قیمت مانند اتان می توانند به عنوان یک منبع جایگزین برای اسید استیک مورد استفاده قرار گیرند. به همین ترتیب اتانول که می تواند به صورت تجدید پذیر از طریق تخمیر تولید شود ، قابل اکسید شدن به اسید استیک است. در واقع تبدیل اتانول به اسید استیک اساسا همان چیزی است که در تخمیر سرکه اتفاق می افتد (توسط میکروب ها) ، اما این کار را می توان به روش کاتالیستی نیز انجام داد. کاتالیست های شیمیایی (مثلا مبتنی بر مس یا پالادیوم) وجود دارند که می توانند بخار اتانول را در حضور اکسیژن با گزینش پذیری بالا به اسید استیک تبدیل کنند. اگر از اتانول زیستی به عنوان خوراک استفاده شود ، این مسیر به تولید اسید استیک سبز منجر خواهد شد. از نظر تاریخی اکسایش بوتان نرمال یکی از فرآیندهای صنعتی اولیه برای تولید اسید استیک بود که پیش از رواج کربونیلاسیون متانول به کار می رفت. در فرآیند اکسایش بوتان ، بوتان معمولا در حضور نمک های فلزی کاتالیستی (مانند استات های کبالت و منگنز در یک حلال) با اکسیژن هوا واکنش داده و اسید استیک به همراه محصولات جانبی مانند دی اکسید کربن و اسیدهای آلی دیگر تولید می کند. این واکنش به فشار و دمای بالا نیاز دارد و اگرچه موثر است ، اما گزینش پذیری و بازده آن نسبت به فرآیند مدرن کربونیلاسیون کمتر است. امروزه اکسایش بوتان کاربرد کمتری دارد ، اما تحقیقات پیرامون بهبود کاتالیست ها در تلاش است کارایی این مسیر اکسایشی را افزایش دهد. وجه مشترک تمامی این روش های اکسایشی ، هدف ساده سازی تولید از طریق به کارگیری مستقیم هیدروکربن ها یا الکل های در دسترس است اما کنترل واکنش به گونه ای که در حد اسید استیک متوقف شود و تا CO₂ اکسید کامل نشود چالشی اساسی است. فرمولاسیون های جدید کاتالیستی و طراحی های نوین راکتور در دست بررسی هستند تا این فرآیندهای اکسیداسیون مستقیم را عملی تر کنند و مسیرهای مکملی در کنار روش غالب مبتنی بر متانول برای تولید اسید استیک فراهم آورند. این نمودار مقایسه ای از مسیرهای اکسایشی مختلف برای تولید اسید استیک را نشان می دهد. همان طور که مشاهده می کنید ، مسیرهای مبتنی بر گاز سنتز و متان بازده بالاتری دارند در حالی که اتان و بیوماس سهم کمتری دارند.
بازیافت کربن : استفاده از CO₂ در تولید اسید استیک
فناوری های نوین تولید اسید استیک بیش از پیش با حوزه بازیافت و استفاده مجدد کربن (CCU) تلاقی پیدا می کنند. ایده اصلی این است که دی اکسید کربن یک محصول زائد و گاز گلخانه ای گرفته شده و به عنوان ماده اولیه برای ساخت اسید استیک استفاده شود و بدین ترتیب چرخه کربن بسته شود. برای به کارگیری CO₂ در سنتز اسید استیک چندین روش وجود دارد. یک راهبرد غیر مستقیم این است که CO₂ را جذب کرده و با هیدروژن به متانول تبدیل کنیم و سپس از روش کربونیلاسیون متانول (مانند فرآیند مونسانتو/کاتیوا) برای تولید اسید استیک بهره ببریم. در این صورت یک مرحله بازیافت کربن را به فناوری تولید موجود متصل کرده ایم. روش های مستقیم تری نیز در دست بررسی هستند. همان طور که اشاره شد ، کاهش الکتروشیمیایی CO₂ می تواند استات را به طور مستقیم در یک سلول الکترولیز تولید کند. در تحقیقات کاتالیستی حتی مشخص شده که با سیستم کاتالیستی مناسب ، CO₂ و H₂ را می توان در یک واکنش یک مرحله ای به اسید استیک تبدیل کرد ، اگرچه بازده چنین واکنشی پایین است. مسیرهای زیستی (مانند استفاده از استوژن ها) نیز وقتی از جریان های CO₂ صنعتی در تخمیر برای تولید اسید استیک بهره می گیرند ، ذیل CCU قرار می گیرند. این رویکردها دارای جذابیت قابل توجه زیست محیطی هستند. اگر انرژی مورد نیاز برای تبدیل CO₂ از منابع تجدید پذیر تامین شود ، اسید استیک حاصل می تواند از نظر کربنی خنثی یا حتی منفی باشد (در یک ارزیابی چرخه عمر). به جای انتشار CO₂ کارخانه ها به اتمسفر می توان آن را به خوراکی برای تولید محصولات تازه تبدیل کرد. با اینکه این ایده بسیار عالی است ، پیاده سازی عملی آن با چالش هایی مشابه سایر طرح های استفاده از CO₂ روبروست : پایداری و سرعت پایین تبدیل ، نیاز به هیدروژن یا برق ارزان و رقابت با فرآیندهای سنتی بسیار ارزان. با این وجود با تاکید جهانی بر کاهش انتشار کربن ، مسیرهای CCU برای تولید اسید استیک از طریق تامین مالی پژوهش ها و پروژه های نمایشی در حال پیشرفت هستند. این رویکردها تغییری آینده نگرانه را نشان می دهند که ممکن است تولید اسید استیک را به ابزاری برای بهبود محیط زیست در کنار تولید صنعتی تبدیل کند.
مقایسه روش های سنتی و نوظهور تولید اسید استیک
با وجود مجموعه ای از فناوری های در دسترس یا در افق ، مقایسه عملکرد آنها در برابر یکدیگر سودمند است. روش های مرسوم مانند کربونیلاسیون متانول از نظر بهره وری و مقیاس استانداردهایی را تعیین کرده اند ، در حالی که رویکردهای جدیدتر در پی بهبود پایداری یا استفاده از منابع متفاوت هستند. هر روش نیازمندی های خوراک ، کاتالیست ، مزایا و چالش های خاص خود را دارد. جدول زیر دید کلی مقایسه ای از چندین روش عمده تولید اسید استیک شامل فرآیندهای قدیمی تثبیت شده و توسعه های نوآورانه ارائه می کنند:
| روش تولید | خوراک های اصلی | نوع کاتالیست یا فرآیند | مزایای اصلی | چالش های کلیدی |
|---|---|---|---|---|
| کربونیلاسیون متانول (فرآیند مونسانتو/کاتیوا) | متانول و CO (از منابع فسیلی) | کاتالیست همگن رودیوم یا ایریدیوم با کمک عامل یدید | بازده و گزینش پذیری بسیار بالا؛ اثبات شده در مقیاس صنعتی بزرگ | نیاز به فلزات گرانبها و هالیدهای خورنده دارد؛ برای جداسازی محلول کاتالیست انرژی زیادی لازم است |
| اکسایش آلکان سبک (مثلاً بوتان) | بوتان + O₂ | اکسایش در فاز مایع (کاتالیستهای استات فلزی) | استفاده از خوراک هیدروکربنی ارزان؛ فناوری قدیمی اما تثبیت شده | گزینش پذیری پایینتر (تولید محصولات جانبی مثل CO₂)؛ فشار و مصرف انرژی بالا؛ امروزه مقرون به صرفه نیست |
| تخمیر بیولوژیک (فرآیند سرکه) | اتانول (از زیست توده) + O₂ | باکتری های اسید استیک (تخمیر هوازی) | خوراک تجدید پذیر؛ شرایط عملیاتی ملایم؛ محصول مناسب مصرف خوراکی | غلظت محصول بسیار پایین (~۵–۱۵٪)؛ فرآیند کند؛ برای تولید شیمیایی در مقیاس بالا صرفه اقتصادی ندارد |
| تخمیر گاز سنتز (مسیر استوژنها) | CO + CO₂ + H₂ (گاز سنتز از گازهای زائد یا زیست توده) | باکتری های بی هوازی (تخمیر استوژنیک) | قابلیت تبدیل گازهای زائد صنعتی به محصول؛ پتانسیل کربن منفی (کاهش CO₂ محیطی) | محدودیت انتقال گاز به مایع؛ غلظت خروجی رقیق؛ فناوری در حال توسعه و هنوز به طور گسترده تجاری نشده است |
| کربونیلاسیون ناهمگن (آزمایشی) | متانول یا دی متیل اتر + CO | کاتالیست جامد (زئولیت ها یا کمپلکس های فلزی روی حامل) | جداسازی کاتالیست آسانتر؛ بدون نیاز به هالیدهای خورنده؛ امکان استفاده از فلزات ارزانتر | فعلاً فعالیت کمتری نسبت به سامانه های همگن دارد؛ مشکلات غیرفعال شدن کاتالیست؛ هنوز در مرحله تحقیق و توسعه |
| تبدیل مستقیم متان (کربونیلاسیون اکسایشی) | متان + O₂ (+ CO یا CO₂) | کاتالیست پیشرفته چند جزئی (مثلاً سایت های دو فلزی) | مسیر تک مرحله ای از متان فراوان؛ امکان فرآیند ملایم با گزینش پذیری بالا | دستیابی به بازده بالا بسیار دشوار؛ عمر کاتالیست و مقیاس پذیری اثبات نشده؛ هنوز به مرحله تجاری نرسیده است |
| کاهش الکتروشیمیایی CO₂ | CO₂ + H₂O (با انرژی الکتریکی) | سلول الکتروشیمیایی با الکتروکاتالیست ویژه | استفاده از CO₂ جذب شده و برق تجدید پذیر؛ پتانسیل فرآیند کربن خنثی | در حال حاضر بازده و سرعت واکنش پایین است؛ نیاز به برق زیادی دارد؛ نیازمند مقیاس گذاری و بهبود دوام کاتالیست است |
| فرآیند فتوکاتالیستی خورشیدی | CO₂ (+ CH₄ یا H₂O) با استفاده از نور خورشید | فتوکاتالیست نیمه رسانا (واکنش با جذب نور) | استفاده مستقیم از انرژی خورشیدی؛ عدم نیاز به خوراک فسیلی یا برق شبکه | بازده بسیار پایین در آزمایش های کنونی؛ نیاز به توسعه چشمگیر کاتالیست؛ تا رسیدن به تجاری سازی فاصله زیادی دارد |




