فهرست عناوین
- معرفی اجمالی اسید استیک و اهمیت آن در شیمی
- ظاهر ، بو و رنگ اسید استیک
- وزن مولکولی و فرمول شیمیایی اسید استیک
- نقطه ذوب ، نقطه جوش و نقطه فلش اسید استیک
- چگالی و ویسکوزیته اسید استیک
- حلالیت اسید استیک در آب و سایر حلال ها
- اسیدیته : Ka، pKa و رفتار در محلول
- واکنش اسید استیک با بازهای معدنی
- واکنش اسید استیک با فلزات فعال
- نقش اسید استیک به عنوان نوکلئوفیل در سنتز آلی
- تولید مشتقات : استرها و انیدریدهای اسید استیک
- واکنش پذیری اسید استیک با مواد اکسیدکننده
- خطرات ایمنی و ویژگی های خوردگی اسید استیک
- طبقه بندی GHS و نکات ایمنی در برگه MSDS
نوشته شده توسط شرکت صنایع استیک ایران
منتشر شده توسط شرکت صنایع استیک ایران
تاریخ انتشار مقاله : 26-02-1404
تاریخ بروزرسانی مقاله : 26-02-1404
تعداد کلمات : 1500
آدرس مقاله : لینک مقاله
خواص فیزیکی و شیمیایی کلیدی اسید استیک

معرفی اجمالی اسید استیک و اهمیت آن در شیمی
اسید استیک (CH₃COOH) یک اسید کربوکسیلیک ساده اما بسیار پرکاربرد در شیمی آلی است. این ترکیب در صنایع غذایی ، دارویی ، نساجی و پتروشیمی به وفور یافت می شود. اسید استیک رقیق به نام سرکه شناخته می شود و در تهیه غذا و ترشی کاربرد گسترده دارد. فرم غلیظ آن اسید استیک یخی در سنتزهای شیمیایی و به عنوان حلال استفاده می شود. اهمیت اسید استیک در واکنش های استری سازی ، تولید مونومرهای وینیل استات و سلولز استات و همچنین در بسیاری از فرآیندهای صنعتی دیگر غیرقابل انکار است. به همین دلیل نیز خرید اسید استیک برای این قبیل صنایع از اهمیت بالایی برخوردار است.
ظاهر ، بو و رنگ اسید استیک
اسید استیک مایعی بی رنگ و شفاف است. بوی تند و مشخصی دارد که به بوی سرکه شباهت دارد. در غلظت های بالا به ویژه در دمای پایین تر از 16.6 درجه سانتیگراد اسید استیک به شکل بلورهای بی رنگ و شفاف جامد (اسید استیک یخی) ظاهر می شود. این بلورها شبیه یخ هستند از این رو به آن اسید استیک یخی گفته می شود. این تغییر حالت فیزیکی خاصیت منحصر به فردی از اسید استیک است.
وزن مولکولی و فرمول شیمیایی اسید استیک
فرمول شیمیایی اسید استیک CH₃COOH است. جرم مولی اسید استیک 60.05 گرم بر مول می باشد. این ترکیب جزو ساده ترین اسیدهای کربوکسیلیک محسوب می شود و دارای یک گروه کربوکسیل (-COOH) متصل به یک گروه متیل (-CH₃) است. ساختار ساده و وزن مولکولی پایین سبب سهولت واکنش پذیری و کاربرد گسترده اسید استیک در سنتزهای شیمیایی شده است.
| نام ترکیب | فرمول شیمیایی | وزن مولکولی (g/mol) | نوع پیوندهای اصلی | وضعیت در دمای اتاق | توضیحات تکمیلی |
|---|---|---|---|---|---|
| اسید استیک خالص | CH₃COOH | 60.05 | کووالانسی قطبی | مایع | اسید آلی ضعیف، بیرنگ، با بوی تند سرکهمانند |
| گروه عاملی کربوکسیلیک | -COOH | — | یک پیوند دوگانه و یک هیدروکسیل | — | ساختار کلیدی در تمام اسیدهای آلی، منشأ رفتار اسیدی |
| فرم یونی (استات) | CH₃COO⁻ | 59.04 | پیوند یونی در نمکها | جامد (در نمکها) | بهصورت نمکهای استات سدیم، کلسیم، و ... در صنایع غذایی و دارویی استفاده میشود |
| اسید استیک یخزده | CH₃COOH (منجمد) | 60.05 | کووالانسی | جامد | زیر 16.6 درجه سانتیگراد منجمد میشود، حالت بلورین دارد |
| اسید فرمیک (مقایسهای) | HCOOH | 46.03 | کووالانسی قطبی | مایع | اسید آلی سادهتر، در مقایسه با اسید استیک وزن مولکولی کمتری دارد |
| اسید پروپیونیک (مقایسهای) | C₂H₅COOH | 74.08 | کووالانسی قطبی | مایع | اسید آلی سنگینتر از اسید استیک، کاربرد مشابه در مواد نگهدارنده مواد غذایی |
نقطه ذوب ، نقطه جوش و نقطه فلش اسید استیک
اسید استیک در دمای 16.6 درجه سانتیگراد ذوب و در 118.1 درجه سانتیگراد می جوشد. نقطه فلش آن حدود 40 درجه سانتیگراد است که نشان دهنده ی قابلیت اشتعال آن می باشد. این ویژگی ها در تعیین روش های نگهداری و جابجایی ایمن اسید استیک اهمیت دارند. نقطه ذوب پایین آن به شکل گیری اسید استیک یخی در دمای اتاق اشاره دارد.
چگالی و ویسکوزیته اسید استیک
در دمای 25 درجه سانتیگراد هر سانتی متر مکعب اسید استیک جرمی برابر با 1.049 گرم دارد. ویسکوزیته آن در شرایط استاندارد متوسط است. چگالی بالا نشان از تراکم مولکولی قابل توجه دارد. ویسکوزیته متوسط رفتار جریان آن را در شرایط مختلف تعیین می کند.
حلالیت اسید استیک در آب و سایر حلال ها
اسید استیک به آسانی در آب ، الکل ها و اتر حل می شود. حلالیت بالای آن در آب به دلیل وجود پیوند هیدروژنی بین مولکول های اسید استیک و آب است که خاصیت دوقطبی را نشان می دهد. این ویژگی کاربرد آن را به عنوان حلال در بسیاری از واکنش های شیمیایی افزایش می دهد.
اسیدیته : Ka، pKa و رفتار در محلول
اسید استیک با ثابت تفکیک اسیدی (Ka) برابر با 1.8 × 10⁻⁵ و pKa برابر با 4.76 یک اسید ضعیف محسوب می شود. این بدان معناست که در محلول های آبی تنها بخشی از مولکول های اسید استیک به یون های استات (CH₃COO⁻) و یون هیدرونیوم (H₃O⁺) تفکیک می شوند. قدرت اسیدی کم اسید استیک آن را برای کاربردهایی که نیاز به کنترل دقیق PH دارند مناسب می سازد. این ویژگی در صنایع غذایی و دارویی بسیار حائز اهمیت است. خاصیت اسیدی ضعیف اسید استیک بر بسیاری از واکنش های شیمیایی آن اثر می گذارد و آن را به یک ماده شیمیایی مفید و کنترل شده تبدیل می کند. غلظت یون های هیدرونیوم در محلول اسید استیک مستقیماً به میزان تفکیک اسید و در نتیجه به غلظت اولیه اسید بستگی دارد.
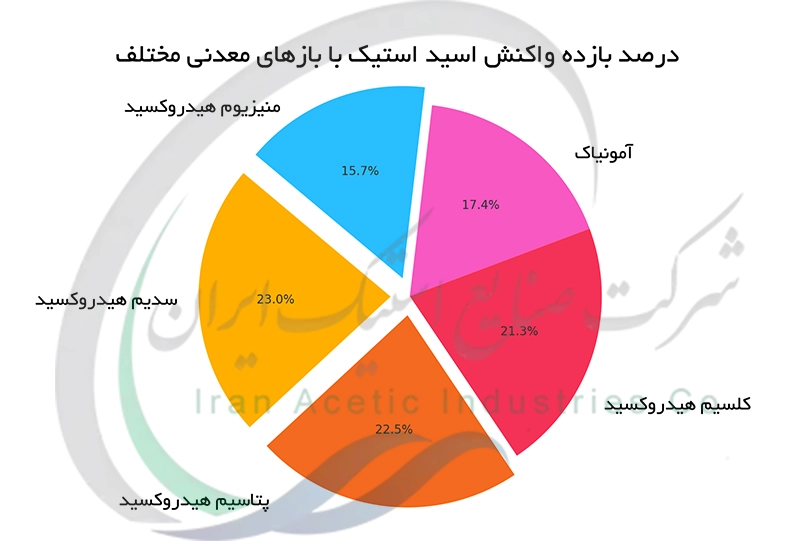
واکنش اسید استیک با بازهای معدنی
اسید استیک با بازهای معدنی مانند سدیم هیدروکسید (NaOH) و پتاسیم هیدروکسید (KOH) واکنش خنثی سازی انجام می دهد. این واکنش نمک استات مربوطه و آب تولید می کند. در واکنش بین اسید استیک (CH₃COOH) و سدیم هیدروکسید (NaOH) ، نمک سدیم استات (CH₃COONa) و آب (H₂O) به عنوان محصولات حاصل می شوند. این واکنش ها گرمازا هستند و به عنوان واکنش های خنثی سازی شناخته می شوند. نمک های استات تولید شده خود ترکیباتی با کاربردهای گسترده در صنایع مختلف هستند. واکنش های خنثی سازی اسید استیک در تیتراسیون های اسید-باز و همچنین در کنترل PH سیستم ها کاربرد فراوانی دارند.
واکنش اسید استیک با فلزات فعال
اسید استیک با فلزات فعال مانند روی (Zn) و منیزیم (Mg) واکنش می دهد. این واکنش ها نمک استات فلز مربوطه و گاز هیدروژن (H₂) تولید می کنند. واکنش بین اسید استیک و فلز روی ، استات روی (Zn(CH₃COO)₂) به عنوان نمک و گاز هیدروژن (H₂) آزاد می شود. سرعت این واکنش ها به عوامل مختلفی از جمله غلظت اسید ، نوع فلز و دما بستگی دارد. تولید گاز هیدروژن در این واکنش ها نشانه ای از واکنش بین اسید و فلز است. این واکنش ها در بسیاری از سنتزهای شیمیایی به عنوان راهی برای تولید هیدروژن یا نمک های استات مورد استفاده قرار می گیرند.
نقش اسید استیک به عنوان نوکلئوفیل در سنتز آلی
گروه کربوکسیل اسید استیک حاوی اکسیژن با جفت الکترون های ناپیوندی است که آن را به یک نوکلئوفیل مناسب تبدیل می کند. این گروه می تواند به کربن های الکتروفیل حمله کرده و پیوند کربن-اکسیژن ایجاد کند. این واکنش ها اغلب در حضور کاتالیزورهای اسیدی یا باز انجام می شوند تا سرعت واکنش افزایش یابد. واکنش های استری سازی نمونه ای از این نوع واکنش ها هستند. در این واکنش ها اسید استیک با الکل ها واکنش داده و استر و آب تولید می کند. گروه کربوکسیل اسید استیک به عنوان نوکلئوفیل در انواع دیگری از واکنش ها مانند واکنش های افزایشی به آلکن های فعال نیز شرکت می کند. در این موارد اسید استیک به پیوند دوگانه کربن-کربن حمله کرده و یک ترکیب جدید تشکیل می دهد. نقش نوکلئوفیلی اسید استیک در سنتز آلی بسیار مهم و متنوع است و در تولید طیف گسترده ای از ترکیبات آلی کاربرد دارد.
تولید مشتقات : استرها و انیدریدهای اسید استیک
اسید استیک با الکل ها در یک واکنش استری سازی واکنش می دهد. این واکنش نیازمند کاتالیزور اسیدی مانند اسید سولفوریک است و در آن گروه هیدروکسیل الکل با گروه کربوکسیل اسید استیک جایگزین شده و استر و آب تولید می شود. اتیل استات یک استر رایج تولید شده از این واکنش است. اسید استیک همچنین می تواند در یک واکنش دهیدراسیون با خود واکنش داده و انیدرید اسید استیک را تولید کند. این واکنش معمولاً با حرارت دادن و استفاده از عوامل دهیدراته کننده مانند اسید فسفریک انجام می شود. انیدرید اسید استیک یک عامل استیلکننده قوی است و به طور گسترده در سنتز ترکیبات آلی استفاده می شود. مشتقات اسید استیک مانند استرها و انیدریدها به دلیل ویژگی های واکنش پذیری متنوع خود در سنتز مواد شیمیایی مختلف از جمله پلیمرها ، داروها و طعم دهنده ها استفاده می شوند.
واکنش پذیری اسید استیک با مواد اکسیدکننده
اسید استیک هم به عنوان یک عامل اکسیدشونده و هم کاهنده عمل می کند. در حضور اکسیدکننده های قوی مانند پرمنگنات پتاسیم (KMnO₄) یا دی کرومات پتاسیم (K₂Cr₂O₇)اسید استیک اکسید شده و به دی اکسید کربن و آب تبدیل می شود. در این واکنش اسید استیک الکترون از دست می دهد و به عنوان یک عامل کاهنده عمل می کند. اما در واکنش با برخی مواد ، اسید استیک می تواند به عنوان یک عامل اکسیدکننده عمل کند. برای مثال اسید استیک برخی از ترکیبات آلی را اکسید کرده و تولید ترکیبات اکسیژن دار می کند. این دوگانگی در رفتار اسید استیک آن را در واکنش های ردوکس با کاربردهای سنتزی متنوع قرار می دهد و نشان از توانایی آن در شرکت در واکنش های اکسایش-کاهش دارد.
خطرات ایمنی و ویژگی های خوردگی اسید استیک
اسید استیک غلیظ خورنده است و تماس مستقیم با پوست یا چشم باعث سوختگی شیمیایی می شود. استنشاق بخارات آن نیز تحریک دستگاه تنفسی را به دنبال دارد. دست زدن به اسید استیک نیازمند رعایت نکات ایمنی است. در صورت تماس با پوست بلافاصله با آب فراوان بشویید و به پزشک مراجعه کنید. از تجهیزات حفاظت فردی (مانند دستکش ، عینک ایمنی و ماسک مناسب) استفاده کنید. اگرچه محلول های رقیق خطرات کمتری دارند اما احتیاط ضروری است. محیط کار باید دارای تهویه مناسب باشد و اسید استیک در ظروف مناسب ، در مکانی خشک و خنک نگهداری شود.
طبقه بندی GHS و نکات ایمنی در برگه MSDS
طبق سیستم جهانی هماهنگ طبقه بندی و برچسب گذاری مواد شیمیایی (GHS) اسید استیک به عنوان ماده قابل اشتعال و خورنده طبقه بندی می شود. برگه اطلاعات ایمنی مواد (MSDS) حاوی اطلاعات جامعی در مورد خطرات مرتبط با اسید استیک ، اقدامات احتیاطی لازم ، روش های حمل و نقل و نگهداری ایمن آن است. MSDS محدودیت های تماس مجاز ، روش های مدیریت پسماند و اقدامات اولیه در صورت بروز حادثه را شرح می دهد. این اطلاعات برای کارکنان درگیر با اسید استیک ضروری است. رعایت دقیق دستورالعمل های MSDS باعث کاهش خطر آسیب به سلامتی و محیط زیست می شود. ذخیره سازی اسید استیک در ظروف مقاوم و به دور از مواد ناسازگار باید رعایت شود.




