فهرست عناوین
- اسید استیک چیست ؟ تعریفی ساده و کاربردی
- ریشه نام گذاری اسید استیک از کجاست ؟
- فرمول شیمیایی اسید استیک چیست ؟
- ساختار مولکولی اسید استیک چگونه است ؟
- وزن مولکولی و عدد اتمی عناصر تشکیل دهنده اسید استیک
- وضعیت فیزیکی اسید استیک در دمای محیط
- تفاوت اسید استیک رقیق و اسید استیک خالص
- خواص شیمیایی کلیدی اسید استیک
- اسید استیک در جدول تناوبی چگونه دسته بندی می شود ؟
- انحلال پذیری اسید استیک در آب و سایر حلال ها
- رفتار اسید استیک در واکنش های شیمیایی
- منابع طبیعی و صنعتی تولید اسید استیک
- کاربردهای مهم اسید استیک در صنایع مختلف
نوشته شده توسط شرکت صنایع استیک ایران
منتشر شده توسط شرکت صنایع استیک ایران
تاریخ انتشار مقاله : 14-02-1404
تاریخ بروزرسانی مقاله : 14-02-1404
تعداد کلمات : 1500
آدرس مقاله : لینک مقاله
تعاریف پایه و فرمول شیمیایی اسید استیک

اسید استیک چیست ؟ تعریفی ساده و کاربردی
اسید استیک با نام رایج تر جوهر سرکه عضوی از خانواده اسیدهای کربوکسیلیک است. این ترکیب آلی ، مایعی بی رنگ با بوی تند و مشخص سرکه است که طعم ترشی قوی دارد. اسید استیک به طور طبیعی در طی تخمیر مواد حاوی الکل مانند سرکه سیب یا سرکه انگور بوجود می آید. اما در مقیاس صنعتی از روش های شیمیایی مختلفی برای تولید این اسید با خلوص بالا استفاده می شود. کاربردهای گسترده اسید استیک در صنایع غذایی (چاشنی ، نگهدارنده) ، تولید پلاستیک ، داروسازی و صنایع شیمیایی دیگر آن را به یکی از مهمترین ترکیبات آلی تبدیل کرده است.
ریشه نام گذاری اسید استیک از کجاست ؟
نام استیک اسید ریشه در زبان لاتین دارد. کلمه acetum در لاتین به معنای سرکه است. از آنجا که اسید استیک به طور طبیعی در سرکه وجود دارد و در واقع عامل اصلی طعم ترش آن است ، این نام به این ترکیب اطلاق شده است. استفاده از واژه استیک برای نام گذاری این اسید نشانگر تاریخی طولانی و ارتباط تنگاتنگ این ماده با سرکه خانگی و فرآیندهای سنتی تخمیر است. بنابراین نام اسید استیک یادآور منشاء طبیعی این ترکیب مهم و کاربردی است. بررسی واژه های مربوط به سرکه در زبان های مختلف به خوبی ارتباط آن ها را با کلمه لاتین acetum نشان می دهد.
فرمول شیمیایی اسید استیک چیست ؟
فرمول شیمیایی اسید استیک به دو صورت نمایش داده میشود : فرمول مولکولی C₂H₄O₂ و فرمول ساختاری CH₃COOH . فرمول مولکولی تعداد و نوع اتم های موجود در یک مولکول اسید استیک را نشان می دهد. اما فرمول ساختاری چیدمان اتم ها در مولکول و پیوندهای بین آن ها را به تصویر می کشد. فرمول ساختاری CH₃COOHبه طور دقیق نشان می دهد که یک گروه متیل (CH₃) به یک گروه کربوکسیل (COOH) متصل است. گروه کربوکسیل مسئول ویژگی های اسیدی این ترکیب است و به دلیل وجود گروه کربونیل (C=O) و گروه هیدروکسیل (-OH)، قابلیت اهدای پروتون (H⁺) و ایجاد واکنش های اسید-باز را دارد.
ساختار مولکولی اسید استیک چگونه است ؟
اسید استیک با فرمول شیمیایی CH₃COOH ساختاری ساده اما قابل توجه دارد. یک گروه متیل (CH₃) به یک گروه کربوکسیل (COOH) متصل است. اتم کربن در گروه کربوکسیل پیوند دوگانه با یک اتم اکسیژن و پیوند ساده با یک گروه هیدروکسیل (-OH) تشکیل می دهد. همین گروه هیدروکسیل است که ویژگی اسیدی اسید استیک را فراهم می کند. وجود این گروه و اتم اکسیژن کربونیل (C=O)، امکان تشکیل پیوند هیدروژنی قوی بین مولکول های اسید استیک را فراهم کرده و خواص فیزیکی خاصی مانند نقطه جوش بالا را به آن می بخشد. این پیوندهای هیدروژنی مولکول های اسید استیک را به هم نزدیک نگه می دارند.
وزن مولکولی و عدد اتمی عناصر تشکیل دهنده اسید استیک
اسید استیک از سه عنصر کربن (C)، هیدروژن (H) و اکسیژن (O) تشکیل شده است. وزن مولکولی اسید استیک جمع وزن اتمی اتم های تشکیل دهنده آن است. با محاسبه بر اساس وزن اتمی کربن (۱۲.۰۱ گرم بر مول) ، هیدروژن (۱.۰۰۸ گرم بر مول) و اکسیژن (۱۵.۹۹۹ گرم بر مول) ، وزن مولکولی اسید استیک (C₂H₄O₂) برابر با ۶۰.۰۵۲ گرم بر مول به دست می آید. عدد اتمی کربن ۶ ، هیدروژن ۱ و اکسیژن ۸ است که تعداد پروتون های هسته هر اتم را نشان می دهد. این اطلاعات پایه و اساس درک خواص فیزیکی و شیمیایی اسید استیک را تشکیل می دهد.
| ردیف | نام عنصر | نماد | عدد اتمی | تعداد اتم در اسید استیک | جرم اتمی (g/mol) | جرم کل در مولکول (g/mol) |
|---|---|---|---|---|---|---|
| 1 | کربن | C | 6 | 2 | 12.01 | 24.02 |
| 2 | هیدروژن | H | 1 | 4 | 1.008 | 4.032 |
| 3 | اکسیژن | O | 8 | 2 | 16.00 | 32.00 |
| 4 | — | |||||
| 5 | جمع | — | — | — | — | 60.05 |
| 6 | فرمول مولکولی: C₂H₄O₂ | |||||
وضعیت فیزیکی اسید استیک در دمای محیط
در شرایط استاندارد دما و فشار (STP) اسید استیک خالص به شکل مایعی بی رنگ ، شفاف و با بوی تند مشخص ظاهر می شود. این مایع با لمس کمی خورنده است و بوی آن تیز و متفاوت است. خاصیت اسیدی و تشکیل پیوندهای هیدروژنی ، نقطه جوش نسبتا بالای این ترکیب (حدود ۱۱۸ درجه سانتیگراد) را توجیه می کند. در دماهای پایین تر از ۱۶ درجه سانتیگراد اسید استیک به حالت جامد بلوری درمی آید که به آن یخ استیک گفته می شود. این تغییر حالت فیزیکی نشان دهنده تأثیر دما بر ساختار مولکولی و برهم کنش بین مولکول های اسید استیک است. این رفتار یکی از ویژگی های فیزیکی منحصر به فرد اسید استیک بوده و عاملی تاثیر گذار در خرید اسید استیک شازند فله می باشد.
تفاوت اسید استیک رقیق و اسید استیک خالص
اسید استیک در دو شکل اصلی یافت میشود : رقیق و خالص (گلاسیال). اسید استیک رقیق محلول آبی اسید استیک با غلظت پایین (معمولا ۴_۵ درصد) است که بیشتر با نام سرکه شناخته می شود. این نوع ، طعم ترش ملایم و کاربردهای غذایی و خانگی دارد. برخلاف آن اسید استیک گلاسیال ، اسید استیک خالص با غلظت بالا (بیش از ۹۹ درصد) است که مایعی بی رنگ با بوی تند و خورندگی بیشتر است. کاربردهای آن عمدتا صنعتی و در سنتزهای شیمیایی می باشد. در واقع تفاوت اصلی در غلظت و در نتیجه شدت خورندگی و کاربردهای آن هاست.
خواص شیمیایی کلیدی اسید استیک
اسید استیک یک اسید ضعیف مونوپروتونیک است. این بدان معناست که تنها یک پروتون (H⁺) را در محلول آبی آزاد می کند. این ترکیب با بازها واکنش داده و نمک های استات (مانند استات سدیم) تشکیل می دهد. همچنین در واکنش های استریفیکاسیون شرکت می کند که طی آن با الکل ها واکنش داده و استر تولید می کند. واکنش با مواد اکسیدکننده قوی مانند پرمنگنات پتاسیم ، دی اکسید کربن و آب تولید می کند. این ویژگی ها اسید استیک را در سنتزهای شیمیایی بسیار متنوع و ارزشمند ساخته است.
اسید استیک در جدول تناوبی چگونه دسته بندی می شود ؟
اسید استیک در جدول تناوبی به طور مستقیم دسته بندی نمی شود زیرا یک ترکیب آلی و نه یک عنصر است. با این حال در طبقه بندی ترکیبات شیمیایی در گروه اسیدهای کربوکسیلیک قرار می گیرد. این دسته از ترکیبات آلی با گروه عاملی کربوکسیل (-COOH) تشکیل شده اند که خاصیت اسیدی آن ها را تعیین می کند اگرچه اسید استیک یک ترکیب آلی است ، به دلیل قدرت اسیدی قابل توجه خود رفتارهایی شبیه به برخی اسیدهای معدنی از خود نشان می دهد ، اما نباید با اسیدهای معدنی اشتباه گرفته شود. این ویژگی دوگانه مهم ترین مشخصه این ترکیب آلی است.
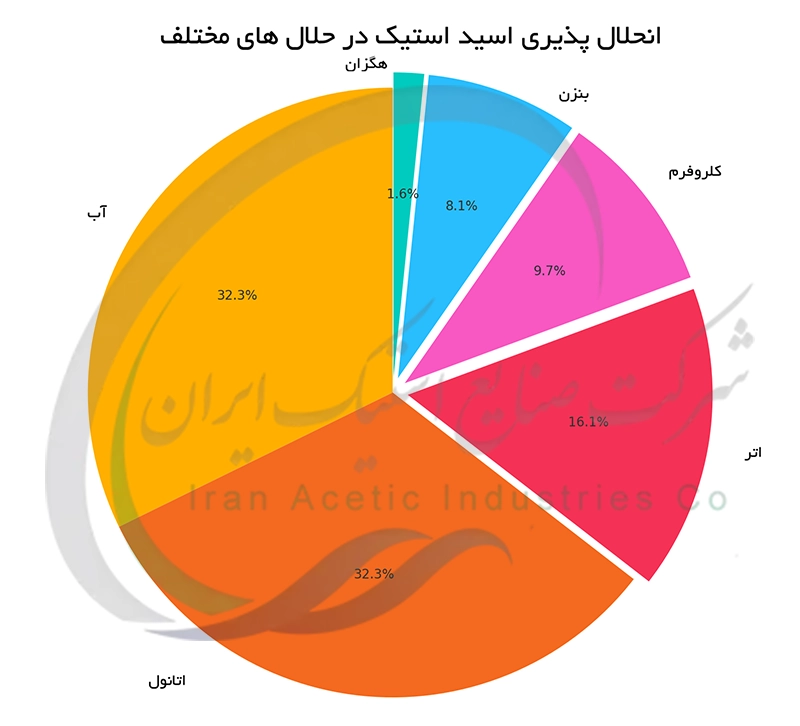
انحلال پذیری اسید استیک در آب و سایر حلال ها
اسید استیک به دلیل ساختار مولکولی قطبی خود در آب به طور کامل و به راحتی حل می شود. این قابلیت انحلال پذیری بالا به تشکیل پیوندهای هیدروژنی قوی بین گروه کربوکسیل (COOH) اسید استیک و مولکول های آب مربوط می شود. مولکول های آب با احاطه کردن مولکول های اسید استیک نیروی جاذبه بین مولکول های اسید استیک را می شکنند و سبب ایجاد یک محلول همگن می شوند. علاوه بر آب ، اسید استیک در حلال های آلی قطبی مانند اتانول و متانول نیز به خوبی حل می شود. اما انحلال پذیری آن در حلال های غیرقطبی مانند هگزان بسیار کم است. این رفتار انحلال پذیری به دلیل ماهیت قطبی گروه کربوکسیل و برهم کنش های بین مولکولی است.
رفتار اسید استیک در واکنش های شیمیایی
اسید استیک در واکنش های شیمیایی گوناگونی نقش دارد. به عنوان یک اسید ضعیف با بازها خنثی شده و نمک های استات را ایجاد می کند. مثلاً واکنش آن با هیدروکسید سدیم ، استات سدیم و آب تولید می کند. یکی دیگر از واکنش های مهم اسید استیک ، استریفیکاسیون است. در این فرآیند اسید استیک با الکل ها واکنش داده و استرهای معطر تولید می کند. این استرها کاربردهای وسیعی در صنایع غذایی ، دارویی و تولید عطر دارند. علاوه بر این اسید استیک در واکنش های اکسیداسیون و احیا نیز شرکت می کند و به دلیل گروه کربوکسیل واکنش پذیری قابل توجهی از خود نشان می دهد.
منابع طبیعی و صنعتی تولید اسید استیک
اسید استیک فراتر از آزمایشگاه در طبیعت نیز ریشه دوانده است. باکتری های سرکه زا طی فرآیند تخمیر مواد قندی مانند میوه ها و آبجو این ترکیب را به وجود می آورند. سرکه نمونه ای از اسید استیک طبیعی با غلظت پایین است. اما نیاز صنایع به حجم وسیع و خلوص بالای اسید استیک راه را برای روش های صنعتی هموار کرده است. روش های متداول صنعتی شامل کربونیلاسیون متانول و اکسیداسیون آکرولون است که محصولی با کیفیت بالا و کنترل شده را فراهم می کنند. این رویکردها تولید اسید استیک را در مقیاس بزرگ و با کیفیت مورد نیاز صنایع مختلف میسر ساخته اند.
کاربردهای مهم اسید استیک در صنایع مختلف
کاربردهای گوناگون اسید استیک از صنایع غذایی تا پزشکی گسترده است. در صنایع غذایی به عنوان چاشنی و نگهدارنده به کار می رود. در صنعت نساجی به عنوان حلال و در فرآیندهای رنگرزی نقش حیاتی دارد. چسب ها و رنگ های بسیاری از این ترکیب در ساختار خود بهره می برند. در صنعت داروسازی به عنوان پیش ماده در ساخت داروهای گوناگون استفاده می شود. همچنین در تولید پلیمرهای استات از جمله استات سلولز (ماده ای در ساخت فیلم عکاسی) نقش کلیدی ایفا می کند. به این ترتیب اسید استیک در پیشرفت فناوری در حوزه های مختلف بسیار موثر است.




